时间:2025-06-25 23:12:26
1、选择题 浓盐酸和次氯酸钙能发生如下反应Ca(ClO)2+4HCl(浓)==CaCl2+2Cl2↑+2H2O用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是①CO2?②HCl?③H2O?④O2
A.①②③
B.②③④
C.②③
D.①④
2、选择题 下列气体中无色无味的是
A.SO2
B.Cl2
C.NO2
D.N2
3、选择题 NaCl是一种化工原料,可以制备一系列物质.下列说法正确的是( )
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.如图所示转化反应都是氧化还原反应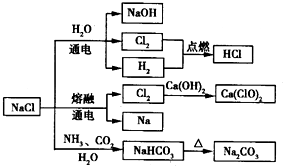
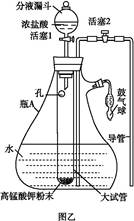
4、实验题 氯水是实验室常需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器)。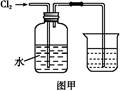
(1)氯水需临时配制的原因是? (用化学方程式表示)。
(2)图甲所示装置中,烧杯内的液体是 。?
(3)用图乙所示装置中配制氯水时,操作步骤如下:
①关闭活塞2 ,打开分液漏斗上口的玻璃塞,再打开活塞1 ,将少量浓盐酸注入大试管内。
②关闭活塞1 ,盖上分液漏斗上口玻璃塞。浓盐酸和大试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A ,使氯气不断溶入水中。用图乙装置能在较短时间内得到饱和氯水。除了在摇动过程中增大了气体和水的接触面以外,另一个重要原因是? 。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是? 。
(4)配制氯水完成后,不必拆卸装置即可从瓶A 中取用少量氯水,方法是?。
5、实验题 (6分)有学生在实验室中向盛有10mL饱和氯化铁溶液的试管里投入足量铝片,观察到如下现象:
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成。
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起。
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚。
(1)产生的红褐色沉淀是_____________,无色气泡的成分是___________。
(2)生成红褐色沉淀的原因是____________________________。
(3)写出生成气泡速率明显加快的两个原因________?____、_________?____。