时间:2025-06-25 23:11:37
1、选择题 下列反应的离子方程式中,书写正确的是( )
A.金属钠投入到蒸馏水中:Na+H2O=Na++OH-+H2↑
B.Fe跟稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
D.铜跟稀硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
2、填空题 (12分)在盛有AgNO3、HCl、Na2CO3、CaCl2、NaCl五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如右表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“—”表示无现象):?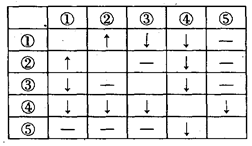 ?
?
(1)写出③、④、⑤三种物质的化学式为:
③______________,④_____________,⑤_______________。
(2)写出下列反应的离子方程式:①+②__________________________。
3、选择题 下列离子方程式书写正确的是
[? ]
A.向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3+ +S2- ==2Fe2++S↓
B.向NH4Al(SO4)2溶液中加入少量的Ba(OH)2溶液:Al3++3OH-+Ba2++SO42-==BaSO4↓+Al(OH)3↓
C.用铜作电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.淀粉碘化钾溶液在空气中变蓝:4I-+O2+H2O==2I2+4OH-
4、实验题 某些化学反应可表示为:A+B→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,则该反应的离子方程式为_________________________________。
(2)若A为黑色固体,C是黄绿色气体,则该反应的离子方程式为__________________。
(3)若A为第二周期的单质,B为第二周期某元素最高价氧化物的水化物,C、D均为气体,则该反应的化学方程式为____________________________________。
(4)若C为NaCl,D是能使澄清石灰水变浑浊的无色无味的气体,则A是______或_______,B为_____________(填化学式,下同)。
(5)若C、D均是能使澄清石灰水变浑浊的气体,则A与B的组合为_____________。
5、选择题 下列离子方程式正确的是
[? ]
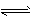 Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+