时间:2025-06-25 23:08:20
1、选择题 已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨)+O2(g)=CO2(g) △H=-393.51kJ ·mol-1
C(金刚石)+O2(g)=CO2(g) △H=-395.41kJ ·mol-1
据此判断,下列说法中正确的是
[? ]
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
参考答案:A
本题解析:
本题难度:简单
2、填空题 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料。回答下列问题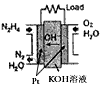
(1)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素和次氯酸钠-氢氧化钠溶液反应获得,尿素法反应的化学方程式为:__________________________。
(2)直接肼燃料电池原理如上图所示,通入N2H4的极为电池的___________极。
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________________。
N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________________。
(4)肼的水合物(水合肼,N2H4·2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下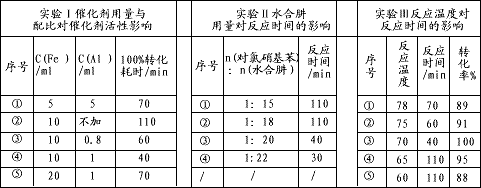
请分别从实验Ⅰ、Ⅱ、Ⅲ组合出最佳条件依次为__________________(选用序号①②③④⑤)。
参考答案:(1)CO(NH2)2+NaClO+2NaOH==N2H4+Na2CO3+NaCl+2H2O (或CO(NH2)2+NaClO==N2H4+CO2+NaCl)
(2)负极
(3)2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947 .6 kJ·mol-1
(4)④④③
本题解析:
本题难度:一般
3、选择题 已知热化学方程式:
H2O(g)=H2(g) + 1/2O2(g)? △H = +241.8kJ/mol
H2(g)+ 1/2O2(g) = H2O(1)? △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是
[? ]
参考答案:B
本题解析:
本题难度:一般
4、选择题 氯原子对O3的分解有催化作用:O3+Cl=ClO+O2?ΔH1;ClO+O=Cl+O2?ΔH2,该反应的能量变化示意图如图所示,下列叙述中正确的是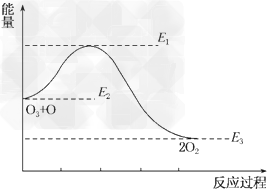
[? ]
A、反应O3+O=2O2的ΔΗ=E1-E2?
B、反应O3+O=2O2的ΔH=E2-E3
C、反应O3+O=2O2是吸热反应?
D、反应O3+O=2O2的ΔH=ΔH1+ΔH2
参考答案:D
本题解析:
本题难度:一般
5、填空题 煤燃烧的反应热可通过以下两个途径来利用:
Ⅰ.利用煤在充足的空气中直接燃烧产生的反应热;
Ⅱ.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
Ⅰ. C(s)+O2(g)====CO2(g);△H=E1 ①
Ⅱ. C(s)+H2O(g)====CO(g)+H2(g);△H=E2 ②
H2(g)+1/2O2(g)====H2O(g);△H=E3 ③
CO(g)+1/2O2(g)====CO2(g);△H=E4 ④
请填写下列空白:
(1)途径Ⅱ与途径Ⅰ相比有较多的优点,即____________;
(2)在上述四个热化学方程式中, ________(填编号)反应的△H>0;
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量正确的关系是(填序号)_____;
A.Ⅰ比Ⅱ多 B.Ⅰ比Ⅱ少 C.Ⅰ与Ⅱ在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为________________。
参考答案:(1)煤的利用率高;变为气体燃料后运输方便;燃烧充分
(2)②
(3)C
(4)E1=E2+E3+E4
本题解析:
本题难度:一般