时间:2025-06-25 23:07:24
1、填空题 (6分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题: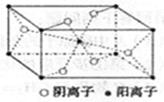
(1)Y基态原子的电子排布式是?。
(2)R2+的水合离子中,提供孤电子对的原子是?。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数比是?。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是?。
参考答案:(1)1s22s22p4 ;(2)O;?(3)2:1 (4)2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
本题解析:根据题意可推知:X是N;Y是O;Z是Mg;R的Cu。(1)O基态原子的电子排布式是1s22s22p4 ; (2)Cu2+的水合离子中,提供孤电子对的原子是H2O分子中的O原子;(3)根据晶胞结构示意图可知:阳离子:1+8÷1/8=2;阴离子:4×1/2+2=4.所以晶胞中阴离子与阳离子的个数比是4:2 = 2:1。(40根据题意,结合电子守恒、原子守恒可得相应反应的离子方程式:2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O。
本题难度:一般
2、填空题 (8分)有下列八种晶体:
A.(水晶)SiO2
B.冰醋酸
C.氧化镁
D.白磷 E.固体氩
F.氢氧化钠 ? G.铝 ? H.金刚石
用序号回答下列问题:
(1) 属于原子晶体的化合物是_________;晶体中含有氢键的是________。
(2) 由极性分子构成的晶体是_________;由正四面体形分子构成的晶体是____;
?含有共价键的离子晶体是________。
(3) 在一定条件下能导电而不发生化学变化的是___________;晶体中只含有范德华
力一种作用的是___________;受热熔化需克服共价键的化合物是___________。
参考答案:(1)A ; B 。(2)B ;D ;F 。 (3)G ;E ;A 。
本题解析:考查化学键、晶体概念及判断。分子间通过分子间作用力形成的晶体是分子晶体,离子间以离子键形成的晶体是离子晶体。原子间以共价键相结合并向空间无限扩展形成空间网状结构的晶体是原子晶体。一般非金属性比较强的F、O、N容易形成氢键。
本题难度:一般
3、选择题 下列原子序数所对应的元素组中,两者可形成离子键的是( )
A.1和17
B.12和9
C.14和6
D.15和8
参考答案:B
本题解析:
本题难度:简单
4、选择题 X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为
[? ]
A.HX
B.H2X
C.XH4
D.XH3
参考答案:D
本题解析:
本题难度:简单
5、选择题 防晒霜之所以能有效地减轻紫外线对人体的伤害,是因为它所含的有效成分的分子中含有π键,这些有效成分的分子中的π电子可在吸收紫外线后被激发,从而阻挡部分紫外线对皮肤的伤害。下列物质中没有防晒效果的是
[? ]
A.氨基苯甲酸
B.羟基丙酮
C.肉桂酸(C6H5-CH=CH-COOH)
D.酒精
参考答案:D
本题解析:
本题难度:简单