时间:2025-06-25 23:06:41
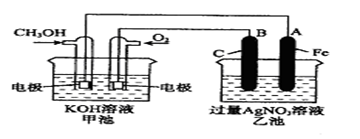
1、填空题 (9分)右图是一个化学过程的示意图。已知甲池的总反应式为: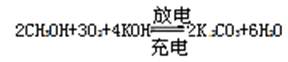
(1)请回答下列电极的名称:通入CH3OH的电极名称是 ,
B(石墨)电极的名称是 。
(2)写出电极反应式: 通入O2的电极的电极反应式是 。
A(Fe)电极的电极反应式为 ,
(3)乙池中反应的化学方程式为 。
参考答案:
本题解析:
⑴CH3OH是还原剂,所在电极为负极,B与电源正极相连,是阳极;
⑵通O2的是正极:O2+2H2O+4e
本题难度:简单
2、选择题 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2=
2H2O,下列有关说法正确的是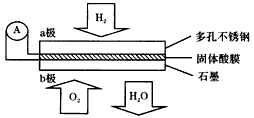
[? ]
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0. 1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
参考答案:D
本题解析:
本题难度:一般
3、填空题 锂电池一种是常用的电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起博器,一般使用时间可长达10年。它的负极用金属锂制成,电池总反应可表示为:Li+MnO2→LiMnO2
试回答:锂电池比容量特别大的原因是_______________。锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因_____________。
最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。 ① 电池的正极反应式为___________________。
② 放电时固体电解质里的O2-离子的移动方向是向______极移动(填正或负)。
参考答案:锂的摩尔质量小;2Li+2H2O = 2LiOH+H2↑;O2+4e-=2O2-;负
本题解析:
本题难度:一般
4、选择题 下列关于充电电池的叙述,不正确的是( )。
A.充电电池的化学反应原理是氧化还原反应
B.充电电池可以无限制的充电放电
C.充电是使放电时的氧化还原反应逆向进行
D.较长时间不使用电池时,最好将电池取出并妥善存放
参考答案:B
本题解析:充电电池理论上是可以永久重复利用的,但在实际应用中总会因为性能等原因而使电解质溶液或者电极变质而失效。所以实际情况下充电电池是不能无限制重复使用的。
本题难度:一般
5、填空题 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答
(1)氢氧燃料电池的能量转化主要形式是________,在导线中电子流动方向为________(用a、b表示)。
(2)负极反应式为__________________。
(3)电极表面镀铂粉的原因为____________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
①反应I中的还原剂是________,反应Ⅱ中的氧化剂是________
②已知LiH固体密度为0.82 g/cm3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为
________
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
参考答案:(1)由化学能转变为电能;由a到b
(2)2H2+4OH--4e-=4H2O(或H2+2OH--2e-=2H2O)
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
(4)①Li;H2O;②1/1148(或8.71×10-4);③32
本题解析:
本题难度:一般