时间:2025-06-25 23:04:07
1、选择题 H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入的NaOH体积V之间的关系如图所示,则原混合溶液中Al3+、Mg2+和SO42—的物质的量之比为(?)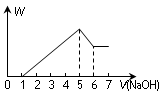
A.1∶1∶1
B.5∶3∶2
C.2∶1∶5
D.3∶2∶2
参考答案:C
本题解析:H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,先发生的是酸碱中和,然后产生了氢氧化铝和氢氧化镁沉淀,最后氢氧化铝溶解,其离子方程式分别为
H++OH-=H2O、Al3++4OH-=AlO2-+2H2O、Mg2++2OH-=Mg(OH)2↓,由图可以知道,设1V积极的氢氧化钠的含量为amol,刚开始为酸碱的中和,所以酸的物质的量为0.5amol,因为Al(OH)3+OH-=AlO2-,有图可以知道铝的物质的量为amol,所以消耗镁的氢氧化钠为6amol-4amol-amol=amol,所以Mg2+的物质的量为0.5amol,所以Al3+、Mg2+和SO42—的物质的量分别为amol、0.5amol、0.5+1.5+0.5=2.5amol,即Al3+、Mg2+和SO42—的物质的量之比为2∶1∶5,所以本题的答案选择C。
点评:本题考查了元素及其化合物,涉及考查了铝及其化合物的性质,该考点是高考考点的重点,本题有一定的难度。
本题难度:一般
2、选择题 海水是镁的主要来源之一,从海水中提取镁可按如下步骤进行:①把贝壳(主要成分是碳酸钙)煅烧成石灰;②在引有海水的渠中加入石灰,经过沉降,然后过滤得沉淀物;③将沉淀物与稀盐酸反应,然后结晶、过滤、干燥;④电解得产品。以上提取镁的全过程中,没有涉及的反应类型有(?)
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
参考答案:C
本题解析:从海水中提取镁的过程涉及的主要反应如下:
CaCO3 CaO+CO2↑
CaO+CO2↑
CaO+H2O=Ca(OH)2
Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
MgCl2(熔融)  Mg+Cl2↑
Mg+Cl2↑
本题难度:简单
3、选择题 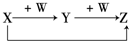 X、Y、Z、W有如图所示的转化关系,则X、W可能是①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2
X、Y、Z、W有如图所示的转化关系,则X、W可能是①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2
A.①②③
B.①②
C.③④
D.①②③④
参考答案:A
本题解析:分析:将选项中的物质带入验证即可,图象中X、Y都能与W反应.
解答:①X为C、W为O 2时,Y为CO,Z为CO 2,且C与O2完全反应即生成CO 2,故正确;
②若X为AlCl 3、W为NaOH,则Y为Al(OH)3,Z为NaAlO 2,过量NaOH与AlCl 3反应生成NaAlO 2,故正确;
③若X为Fe、W为HNO3,Fe过量时生成Fe(NO 3)2,继续与HNO3反应生成Fe(NO 3)3,Fe在过量HNO 3中生成Fe(NO 3)3,故正确;
④若X为S、W为O2,S与氧气反应生成二氧化硫,在催化剂条件下二氧化硫与氧气反应生成三氧化硫,但硫单质不能与氧气反应生成直接三氧化硫,故错误.
点评:本题考查元素化合物中的连续反应,思维容量较大,需要对物质间的转换关系及转换条件非常熟悉,否则易出错.
本题难度:简单
4、选择题 下列说法不正确的是?
[? ]
A.在食品保鲜袋中放置硫酸亚铁和硅胶可以防止食品氧化变质及受潮
B.金属元素的原子只有还原性,其阳离子只有氧化性
C.玻璃、水泥、陶瓷都是硅酸盐材料
D.Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al 并不滴落
参考答案:B
本题解析:
本题难度:简单
5、简答题 (14分)铁、铝、铜、硅及其合金材料在生产生活中有着广泛的应用。请回答下列有关问题。
(1)目前已冶炼出纯度达99.9999%的铁。下列关于纯铁的叙述错误的是?
(填字母)。?
A.硬度比钢小,熔点比钢高
B.不能与盐酸反应
C.与不锈钢成分相同
D.在冷的浓硫酸中钝化
E.在潮湿的空气中放置不易生锈
(2)铝热反应可用于焊接钢轨、冶炼熔点较高的金属。请写出用V2O5冶炼钒的化学方程式: ? ? ?
(3)①铜在干燥的空气中性质稳定,在潮湿的空气里会被锈蚀形成一层绿色的铜锈,反应的化学方程式是 ? ? ?
②工业上常以黄铜矿为原料,采用火法溶炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,该反应的氧化剂是 ?
6Cu+SO2↑,该反应的氧化剂是 ?
③将铜粉放入稀硫酸中加热并不断鼓入空气,铜溶解,产物只有硫酸铜与水 。
该反应的化学方程式:?,
此法比直接用浓硫酸与铜反应有两个明显的优点:?
??。?
(4)制备高纯硅的流程如下图:
写出石英砂制备粗硅的化学方程式:
?。
参考答案:(14分,每空2分)(1)BC?
(2)10Al+3V2O5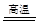 10V+5Al2O3
10V+5Al2O3
(3)①2Cu+O2+H2O+CO2=Cu2(OH)2CO3
②? Cu2O、Cu2S
③2H2SO4+2Cu+O2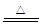 2CuSO4+2H2O
2CuSO4+2H2O
制取相同量的硫酸铜消耗硫酸少;不产生有毒气体
(4)2C+SiO2?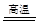 ?Si+2CO
?Si+2CO
本题解析:(1)A、纯铁比合金的熔点高,硬度小,正确;B、能与盐酸反应,错误;C、不锈钢的成分中除含铁外,还含有非金属碳,成分不同,错误;D、铁在冷的浓硫酸中发生钝化,正确;E、高纯铁因为不含碳,即使在潮湿空气中也不易形成原电池而生锈,正确,答案选BC;
(2)V2O5与Al反应冶炼钒,化学方程式是10Al+3V2O5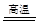 10V+5Al2O3
10V+5Al2O3
(3)①铜与空气中的氧气、水、二氧化碳反应生成碱式碳酸铜,化学方程式为2Cu+O2+H2O+CO2=Cu2(OH)2CO3
②氧化还原反应中氧化剂是指元素化合价降低,得电子的物质,2Cu2O+Cu2S 6Cu+SO2↑中,元素化合价降低的是Cu,所以氧化剂是Cu2O、Cu2S;
6Cu+SO2↑中,元素化合价降低的是Cu,所以氧化剂是Cu2O、Cu2S;
③铜与氧气、稀硫酸在加热条件下反应生成硫酸铜和水,化学方程式为2H2SO4+2Cu+O2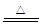 2CuSO4+2H2O;此法比直接用浓硫酸与铜反应有两个明显的优点:制取相同量的硫酸铜消耗硫酸少;不产生有毒气体而污染空气;
2CuSO4+2H2O;此法比直接用浓硫酸与铜反应有两个明显的优点:制取相同量的硫酸铜消耗硫酸少;不产生有毒气体而污染空气;
(4)石英砂的主要成分是二氧化硅,与碳在高温条件下反应生成硅单质和一氧化碳,化学方程式:
2C+SiO2?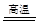 ?Si+2CO
?Si+2CO
本题难度:一般