时间:2025-06-25 23:02:38
1、选择题 特大洪水过后,受灾地区的水源常被严重污染,下列物质中能对污染的饮用水起消毒杀菌作用的是
A.生石灰
B.明矾
C.绿矾
D.漂白粉
参考答案:D
本题解析:明矾、绿矾不能消毒,可净水;生石灰可杀菌消毒,但不能作为饮用水,因为碱性太强;漂白粉可杀菌消毒,消毒后水可作饮用水.
本题难度:简单
2、选择题 标准状况下有22.4L氯气和氢气的混合气体,在一密闭容器中使其充分反应.冷却后将此气体与1L1mol/LNaOH溶液充分反应,最后此溶液( )
A.一定显酸性
B.一定显碱性
C.可能显酸性,可能显碱性,也可能中性
D.以上无正确答案
参考答案:混合气体的物质的量为n=VVm=22.4L22.4L/mol=1mol,
当n(Cl2)=n(H2)=0.5mol时,
?Cl2+H2?点燃?.?2HCl
? 1mol?2mol
0.5mol? 1mol
HCl+NaOH=NaCl+H2O
1mol?1mol
1mol?1mol
当氯化氢和氢氧化钠恰好反应时,溶液显中性;
当n(Cl2)>n(H2)=0?时,气体全部为氯气,所以和氢氧化钠发生的反应为:
Cl2+2NaOH=NaCl+NaClO+H2O
1mol?2mol?
0.5mol?1mol?
与氢氧化钠反应的氯气为0.5mol,剩余的0,5mol氯气和水反应,
Cl2+H2O=HCl+HClO
所以反应后的溶液呈酸性;
当n(H2)>n(Cl2)=0?时,气体全部为氢气,氢气和氢氧化钠溶液不反应,所以溶液呈碱性.
故选C.
本题解析:
本题难度:一般
3、简答题 氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请回答下列问题:
(1)该反应的离子方程式为______;
(2)估算该反应的平衡常数______(列式计算)
(3)在上述平衡体系中加入少量NaOH固体,平衡将向______移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将______(填“增大”、“减小”或“不变”),平衡将向______移动.
参考答案:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,故答案为:Cl2+H2O?H++Cl-+HClO;
(2)在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;依据平衡三段式列式计算得到平衡浓度:
? Cl2+H2O?H++Cl-+HClO
起始浓度:0.09? ?0? ?0?0
转化浓度:0.03? 0.03?0.03?0.03
平衡浓度:0.06? ?0.03?0.03?0.03
K=c(H+)c(Cl-)c(HClO)c(Cl2)=0.03×0.03×0.030.06=4.5×10-3
故答案为:4.5×10-3;
(3)在上述平衡体系中加入少量NaOH固体,会和平衡状态下的氢离子反应,平衡正向进行,故答案为:右;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,平衡都向正反应方向移动,氯气的溶解量会增加,故答案为:增大;右.
本题解析:
本题难度:一般
4、选择题 下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用排水集气法便可以收集到纯净的氯气
C.氯气有漂白性
D.自来水常用氯气来杀菌、消毒
参考答案:A、闻气体的方法是用手轻轻的在瓶口扇动,仅使少量的气体飘入鼻孔,不能直接用鼻子闻,故A错误;
B、因氯气易溶于水且能和水反应,生成次氯酸和盐酸,所以使用向上排空气法或者排饱和食盐水的方法收集氯气,故B错误;
C、干燥的氯气不能够使有色物质褪色,说明氯气不具有漂白性,氯气与与水反应生成的次氯酸具有漂白性,故C错误;
D、氯气与水反应生成次氯酸,次氯酸具有强氧化性,可以杀菌、消毒,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 下列关系图中,A是一种正盐,B为气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下图所示的转化关系(其它反应产物和所需条件均已略去)。则下列说法中不正确的是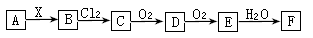
A.当X是强酸时,A~F均含同一种元素,F可能为H2SO4
B.当X是强碱时,A~F均含同一种元素,F可能为HNO3
C.B和Cl2的反应为氧化还原反应
D.当X是强酸时,常温下C为气态单质
参考答案:D
本题解析:根据题意知,A为既可以和强酸反应,又可以和强碱反应的一种正盐,C能发生连续氧化,F为强酸,则X只能是硫化铵。A、A是硫化铵时,当X是强酸时,B为硫化氢,C为硫单质,D为二氧化硫,E为三氧化硫,F为硫酸,正确;B、A是硫化铵时,当X是强碱时,B为氨气,C为氮气,D为一氧化氮,E为二氧化氮,F为硝酸,正确;C、硫化氢或氨气和氯气发生的反应均是置换反应,一定是氧化还原反应,正确;D、当X是强酸时,C为硫单质,常温下是固态,错误。
本题难度:一般