时间:2025-06-25 22:57:46
1、填空题 元素周期表有多种形式,下图是一种三角形元素周期表的一部分,图上标有第ⅦA族、第IA 族钾两种元素的位置。 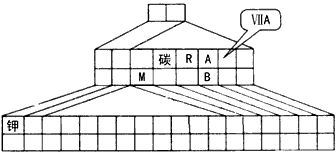
回答下列问题:
(1)以上表中所列的六种元素中,其最高价氧化物的水化物呈弱酸性的是____(填元素符号);其气态氢化物最稳定的是____(填化学式)。
(2)请在图中将过渡元素(副族和Ⅷ族)所在的位置涂黑,并在图中画出金属元素和非金属元素的分界线。
(3)A元素和B元素形成的化合物能与另一含A元素的化合物发生化学反应,该反应既是化合反应也是氧化还原反应,写出该反应的化学方程式_____________。
参考答案:(1)C;H2O (2)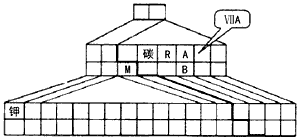 (3)SO2+H2O2=H2SO4
(3)SO2+H2O2=H2SO4
本题解析:
本题难度:一般
2、选择题 依据元素周期表及元素周期律,下列推断正确的是
[ ? ]
A.H3BO3的酸性比H2CO3的强
B.Mg(OH)2的碱性比Be(OH)2的强
C.HCl、HBr、HI的热稳定性逐渐增强
D.若M+和R2-的核外电子层结构相同,则原子序数:R>M
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列有关碱金属元素的性质,从上到下递变规律正确的是( )
A.金属性逐渐减弱
B.化合价逐渐升高
C.失电子能力逐渐增强
D.最高价氧化物对应的水化物碱性逐渐减弱
参考答案:因碱金属元素的具有相似性与递变性可知:
A、因同一主族,从上到下,电子层数逐渐增多,原子半径逐渐增大,金属性逐渐增强,故A错误;
B、因碱金属元素的最外层电子数为1,最高化合价都为+1,故B错误;
C、因同一主族,从上到下,电子层数逐渐增多,原子半径逐渐增大,失电子能力逐渐增强,故C正确;
D、因同一主族,从上到下,电子层数逐渐增多,原子半径逐渐增大,金属性逐渐增强,金属性越强,最高价氧化物对应的水化物碱性越强,故D错误.
故选:C.
本题解析:
本题难度:简单
4、选择题 下列说法或做法正确的是
A.铜能溶于氯化铁溶液中,是由于Fe3+的氧化性比Cu2+强
B.金属钠着火燃烧时,用泡沫灭火器灭火
C.浓硫酸可用铝槽车运输,是由于常温下铝与浓硫酸不会发生反应
D.做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象
参考答案:A
本题解析:A、由于铁离子的氧化性强于铜离子的氧化性,因此铜能溶于氯化铁溶液中,A正确;B、金属钠着火时生成过氧化钠,过氧化钠能和CO2反应生成碳酸钠和氧气,所以金属钠着火燃烧时,不能用泡沫灭火器灭火,应该用沙子扑灭,B不正确;C、常温下铝在浓硫酸中发生钝化,因此浓硫酸可用铝槽车运输,但钝化是化学变化,C不正确;D、钠极易与水反应,所以做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入预先加入含有酚酞的水的烧杯中,然后观察并记录实验现象,D不正确,答案选A。
本题难度:一般
5、选择题 某元素的最常见的化合价为-1价,则该元素的原子最外电子层排布式是
A.ns2
B.ns2np2
C.ns2np4
D.ns2np5
参考答案:D
本题解析:
本题难度:简单