时间:2025-06-25 22:49:23
1、选择题 已知甲、乙、丙、丁代表四种纯净物。甲(g)+2乙(g) 丙(g)+丁(g),△H=-akJ/mol(a>0)?下列说法正确的是(?)
丙(g)+丁(g),△H=-akJ/mol(a>0)?下列说法正确的是(?)
A.甲的能量一定大于丙的能量
B.该反应不需要加热
C.1mol甲与2mol乙总能量高于1mol丙和1mol丁总能量
D.该反应表示:1mol甲与2mol乙在一定条件下反应放出热量为akJ
参考答案:C
本题解析:依题意,该反应正反应是放热反应,它只表示反应物1mol甲与2mol乙总能量高于生成物1mol丙和1mol丁总能量,并不能表示甲的能量一定大于丙的能量,所以A错误,C正确;好多的放热反应也必须先加热才能进行,所以B错误;该反应方程式,表示1mol甲(g)与2mol乙(g)恰好完全反应生成气态丙和气态丁时放热量为akJ,由于该反应是可逆反应,只提供1mol甲(g)与2mol乙(g)并不能完全反应,放出的热量小于akJ。
本题难度:一般
2、选择题 CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);ΔH=-574 kJ/mol
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g); ΔH=-1160 kJ/mol
下列说法不正确的是 ( )
A.反应①②均为放热反应
B.反应①②转移的电子数相同
C.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-a kJ/mol,a<574
D.若用标准状况下4.48 L CH4通过上述反应还原NO2至N2,放出的热量为173.4 kJ
参考答案:C
本题解析:A正确,ΔH<0为放热反应;B正确,C元素的化合价都由—4价升高到+4价;
C错,气态水变成液态水要放出热量,所以,a>574;C正确;由热化学反应方程式可得标准状况下4.48 L CH4通过上述反应还原NO2至N2,放出的热量为173.4 kJ
本题难度:困难
3、填空题 (17分)针对化学反应中的能量变化解决下列问题。
(1)测定稀硫酸和稀氢氧化钠中和热(中和热为57.3 kJ·mol-1)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3 kJ·mol-1,原因可能是 (填字母)。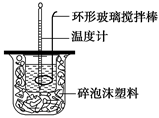
a.实验装置保温、隔热效果差
b.读取混合液的最高温度记为终点温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)。
H2(g)+1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
参考答案:
本题解析:
本题难度:一般
4、选择题 根据四种变化:①Fe(s)→Fe(g);②2H2(g)+ O2(g)=2H2O(g) △H="-482" kJ·mol-1;
③C(s)+CO2(g)=2CO(g);④NaOH(s)=Na+(aq)+OH-(aq)。 请回答下列问题
⑴上述变化中,需要吸收热量的是 (请填变化的代码①②③④,下同)。
⑵上述变化中,体系的混乱度增大的是 。
⑶已知下列两种键能,H-H:436 kJ·mol-1、O-H:463 kJ·mol-1,请计算断裂1 molO2(g)中的共价键需要吸收 kJ的能量。
⑷下面几种说法中。正确的是 [
A.化合反应都大多是放热反应
B.凡是需要加热的反应,都是吸热反应
C.体系的混乱度增大的反应都是吸热反应
D.中和反应是放热反应,其化学能可以转化成电能
参考答案:(1)①③④ (2)①③④ (3)498 (4)A
本题解析:(1)铁由固态变为气态是物理变化,但需要吸热,氢气燃烧是放热反应,碳与CO2反应生成CO的是吸热反应,氢氧化钠电离是吸热过程,所以需要吸收热量的是①③④。
(2)同一种物质在气态是熵值最大,氢气燃烧熵值减小,碳与CO2反应是体积增大的可逆反应,电离过程是熵值增大的,所以上述变化中,体系的混乱度增大的是①③④。
(3)反应热=反应物的键能-生成物的键能,所以根据2H2(g)+ O2(g)=2H2O(g) △H="-482" kJ·mol-1可知,2×436 kJ·mol-1+x-4×463 kJ·mol-1=-482 kJ·mol-1,解得x=498kJ·mol-1,即断裂1 molO2(g)中的共价键需要吸收498的能量。
(4)A、化合反应都大多是放热反应,A正确;B、反应是放热反应还是吸热反应与反应条件无关系,只与反应物总能量和生成物总能量的相对大小有关系,因此凡是需要加热的反应,都是吸热反应是错误的,B不正确;C、体系的混乱度增大的反应不一定都是吸热反应,C不正确;D、中和反应是放热反应,但不是氧化还原反应,因此其化学能不可以转化成电能,D不正确,答案选A。
考点:考查化学反应中的能量变化、反应热计算以及熵值判断等
本题难度:一般
5、选择题 已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,其它相关数据如下表:
| | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
参考答案:D
本题解析:蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,根据ΔH=反应物的总键能-生成物的总键能="436+a+30-2×369=" -72,解得a=200,答案选D。
考点:考查化学反应的热效应与键能的关系
本题难度:一般