时间:2025-06-25 22:45:27
1、实验题 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下: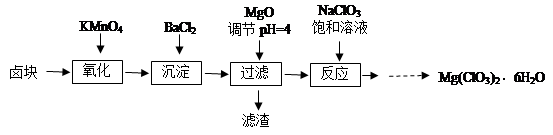
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S )随温度(T )变化曲线如图所示。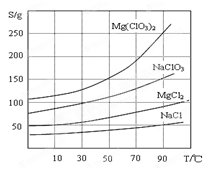
(1)过滤所需要的主要玻璃仪器有?。
(2)加入BaCl2的目的是?,加MgO后过滤所得滤渣的主要成分为?。
(3)加入NaClO3饱和溶液后发生反应的化学方程式为?
(4)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol·L-1 K2Cr2O7?溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7?溶液15.00 mL。
①写出步骤2中发生反应的离子方程式:?;
②产品中Mg(ClO3)2·6H2O的质量分数为?。
2、选择题 2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希发明了“利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用氢核磁共振谱,它是根据不同环境的氢原子在氢核磁共振谱给出的信号不同来确定有机物分子中的不同的氢原子。下列有机物在氢核磁共振谱中只给出一个信号的是
A.HCHO
B.CH3OH
C.HCOOH
D.CH3COOCH3
3、实验题 (8分)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器除F外还有?(填代号,限填2项)。
A.试管? B.瓷坩埚? C.坩埚钳? D.铁三脚架
E.泥三角? F.酒精灯? G.烧杯? H.量筒
(2)第2步:Iˉ溶液的获取。操作是?。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用(填代号)____________。
A.浓硫酸? B.新制氯水? C.KMnO4溶液? D.H2O2
理由是?
(4)第4步:碘单质的检验。取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
4、选择题 下列除杂的操作方法不正确的是 (?)
A.NO中有少量的NO2:用水洗涤后再干燥
B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C.N2中有少量的O2:通过灼热的铜网
D.CO2中混有少量的SO2气体:通过饱和NaHCO3溶液洗气
5、选择题 在标准状况下,等质量的下列气体所占体积最大的是
A.O2
B.CO2
C.NH3
D.N2