时间:2025-06-25 22:38:54
1、选择题 下列叙述正确的是?①氯气的性质很活泼,它与氢气混合后立即发生爆炸?②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收?③新制氯水的氧化性强于久置氯水④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液?⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
A.①②③
B.②③④
C.③
D.③⑤
2、填空题 (12分)A、B、C、D四种物质中均含有氯元素。
①室温下单质A与某种常见一元强碱溶液反应,可得到B和C。B的焰色反应为黄色,C是84消毒液的有效成分。
②化合物D受热催化分解,可制得一种气体,该气体能使带火星的木条复燃。
(1)写出A、B、C、D的名称:
A、_______________B、_______________C、_______________D、_______________
(2)写出①中的化学反应方程式:_______________________________
(3)写出②中的化学反应方程式:_______________________________
3、实验题 某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱的反应的过程中放出热量。温度较高时,氯气和碱还能发生如下反应:6Cl2 + 6Ca(OH)2 5CaCl2 + Ca(ClO3)2 + 6H2O
5CaCl2 + Ca(ClO3)2 + 6H2O
该兴趣小组设计了下列实验装置,进行实验。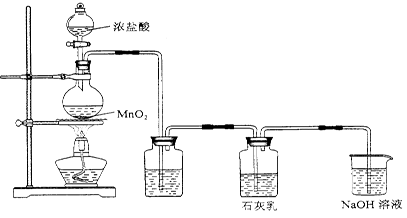
甲?乙?丙?丁
请回答下列问题:
(1)①甲装置中发生反应的化学方程式是?。
②乙装置中的试剂是?,作用是?。
③该兴趣小组用300mL 12mol/L盐酸与17.4g MnO2制备氯气,并将所得氯气与过量的石灰乳反应。则理论上最多可制得标况下氯气?L,Ca(ClO)2?g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO—、ClO3— 两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。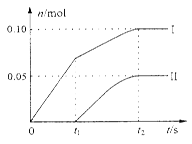
①图中曲线Ⅱ表示?离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为?mol。
③另取一份与②等物质的量Ca(OH)2的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl—的物质的量为0.35mol,则产物中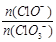 = ??。
= ??。
4、选择题 下列各组物质中,每一种物质都能使溴水褪色的是
[? ]
A.AgNO3溶液、CCl4、碘水
B.Na2SO3溶液、FeCl3溶液、H2S溶液
C.FeCl2溶液、KOH溶液、镁粉
D.NaOH溶液、CO气体、氯水
5、选择题 下列溶液能使红色花瓣快速褪色的是
[? ]
A.稀盐酸?
B.新制氯水
C.氯化钙稀溶液?
D.生理盐水