时间:2025-06-25 22:33:59
1、填空题 已知A经如右图所示的过程转化为D,?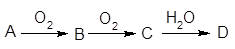
请回答下列问题:
(1)若A为非金属单质,且常温下为淡黄色固体,B为刺激性气味的无色气体,能使品红溶液褪色,D为强酸。
①D的化学式是??。
②在工业生产中B气体的大量排放被雨水吸收后形成了?而污染了环境。某工厂净化残余的B气体装置如图,则除去B气体的总反应方程式是?。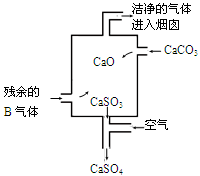
(2)若A是能使酚酞试液变红的气体。D是一种强酸。写出A→B的化学方程式?;工业生产上,以34吨A为原料,最多可以生产63%的D酸?吨。
2、计算题 在273℃、202kPa时,将44.8升NH3与128克O2混合后,充入一密闭容器,加Pt并升温至700℃,充分反应后,冷却到室温。
(1)在室温下得到的产物是什么?
(2)若该产物密度为1.44克/毫升,则其百分比浓度和物质的量浓度各为多少?(保留3位有效数字)
3、选择题 除去NaCl中混有的NH4Cl的最佳方法是(?)
A.利用溶解度不同采用结晶法
B.加入NaOH溶液
C.直接加热
D.加入AgNO3溶液
4、选择题 在某稀硝酸的溶液中,加入5.6g铁粉充分反应后,铁粉全部溶解,放出NO气体,溶液质量增加3.2g,所得溶液中Fe2+和Fe3+物质的量之比为(?)
A.1:1
B.3:2
C.2:1
D.4:1
5、选择题 含n g硝酸的稀溶液恰好和m g铁粉完全反应若有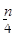 g HNO3被还原成NO,n:m可能
g HNO3被还原成NO,n:m可能
A.1:1
B.2:1
C.3:1
D.9:2