时间:2025-06-25 22:28:25
1、填空题 常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度MCl的水解程度______.(填“>”、“<”、或“=”)
参考答案:常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,溶液中的溶质是等物质的量浓度的MOH和MCl,测得混合溶液的pH<7,说明M+的水解程度大于MOH的电离程度,故答案为:<.
本题解析:
本题难度:简单
2、选择题 已知氨水中存在电离平衡NH3·H2O 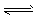 NH4++OH-,下列有关说法正确的是
NH4++OH-,下列有关说法正确的是
[? ]
参考答案:B
本题解析:
本题难度:一般
3、选择题 0.1 mol·L-1某酸HA溶液的pH=2,则该溶液中有关浓度关系式正确的是
A.c(H+)>c(A-)? B.c(H+)>c(HA)? C.c(OH-)>c(HA)? D.c(HA)>c(A-)
参考答案:AD
本题解析:c(酸)= 0.1 mol/L,pH=2,c(H+)=0.01mol/L< c(酸).所以该酸是弱酸。A. 在溶液中除了存在酸的电离平衡HA H+ +A-,外还存在水的电离平衡:H2O
H+ +A-,外还存在水的电离平衡:H2O H+ + OH-,所以c(H+)>c(A-)。正确。B.酸HA的电离作用是很微弱的。尽管H+由酸电离与水电离两部分产生,但其物质的量是很小的。因此c(HA)> c(H+)。错误。C.酸的浓度远大于水电离产生的H+ 或OH-的浓度。所以c(HA)> c(OH-)。错误。D.酸是弱电解质,其电离程度很小,酸分子的浓度远大于其电离产生的离子的浓度,所以c(HA)>c(A-)。正确。
H+ + OH-,所以c(H+)>c(A-)。正确。B.酸HA的电离作用是很微弱的。尽管H+由酸电离与水电离两部分产生,但其物质的量是很小的。因此c(HA)> c(H+)。错误。C.酸的浓度远大于水电离产生的H+ 或OH-的浓度。所以c(HA)> c(OH-)。错误。D.酸是弱电解质,其电离程度很小,酸分子的浓度远大于其电离产生的离子的浓度,所以c(HA)>c(A-)。正确。
本题难度:一般
4、选择题 已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH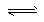 CH3COO-?+ H+,要使溶液中
CH3COO-?+ H+,要使溶液中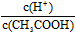 值增大,可以采取的措施是?
值增大,可以采取的措施是?
[? ]
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列说法正确的是?
A.0.1 mol·L-1的醋酸溶液加水稀释,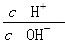 减小
减小
B.体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少
C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW变大
D.常温下,V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,若混合液显中性,则V1≤V2
参考答案:A
本题解析:向水中加入少量固体硫酸氢钠,c(H+)增大,但KW只与温度有关,故KW保持不变,C错;若HA为强酸,则V1=V2,若HA为弱酸,则V1>V2,D错。
本题难度:一般