时间:2025-06-25 22:28:25
1、选择题 常温时,pH值为3的CH3COOH和pH为11的NaOH溶液等体积混合,混合后溶液pH为( )
A.pH>7
B.pH< 7
C.pH=7
D.无法判断
2、选择题 等体积,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)变化的示意图所示,下列说法正确的是( )
A.物质酸性的比较:CH3COOH>HSCN>H2CO3
B.反应结束后所得两溶液中,c(CH3COO-)>c(SCN-)
C.上述三种溶液中由水电离的c(OH-)大小:NaHCO3>CH3COOH>HSCN
D.CH3COOH溶液和NaHCO3溶液反应所得溶液中:c(CH3COO-)+c(CH3COOH)=0.10mol?L-1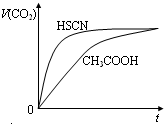
3、填空题 在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表: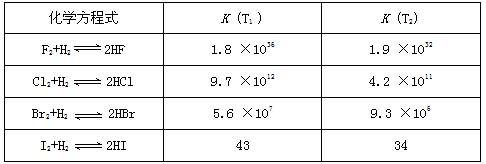
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,X2的平衡转化率逐渐降低
b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱
d. HX的还原性逐渐
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。 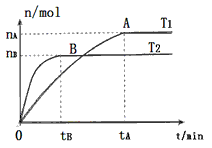
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析上图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a. c(H+)
b. Ka(HF)
c. c(F-)/c(H+)
d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式____________ 、_____________ 。
4、填空题 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。如25℃时有HA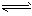 H++A-,则电离平衡常数
H++A-,则电离平衡常数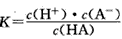 ,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。
,K只与温度有关,c为各微粒的平衡浓度。下表是25℃时几种常见弱酸的电离平衡常数。 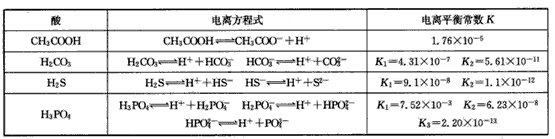
回答下列各题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱的关系是___
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是 ____,最弱的是____。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在 着数量上的规律,此规律是____,产生此规律的原因是________。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得25℃时cmol/L的CH3COOH的电离度为a(当弱电解质在溶液里达到电离平衡时,溶液中已电离的电解质分子占原来总分子数的百分数叫做该电解质 的电离度)。试表示该温度下醋酸的电离平衡常数K=____。
5、选择题 醋酸是电解质,下列事实都能说明醋酸是弱电解质的组合是(?)
①醋酸与水能以任意比互溶?②醋酸溶液能导电
③醋酸溶液中存在醋酸分子?④0.1 mol/L醋酸的pH比0.1 mol/L盐酸pH大
⑤醋酸能和碳酸钙反应放出CO2?⑥常温下0.1 mol/L醋酸钠溶液pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦
B.③④⑤⑥
C.③④⑥⑦
D.①②