时间:2025-06-25 22:16:58
1、选择题 下列各物质所含原子数目,按由大到小顺序排列的是
①0.6mol NH3 ②标准状况下22.4L He
③4℃9mL水(ρ=1g/mL) ④19.6g H2SO4
A.②①③④
B.①③④②
C.①④③②
D.②③④①
参考答案:B
本题解析:①0.6mol NH3含原子2.4 mol;②标准状况下22.4L He含原子1 mol; ③4℃9mL水(ρ=1g/mL),质量为9g,物质的量为0.5 mol,含原子1.5 mol;[④19.6g H2SO4的物质的量为0.2 mol,含原子1.4 mol;含原子数目,按由大到小顺序排列的是①③④②,故B正确。
考点:本题考查物质的量。
本题难度:一般
2、选择题 20℃时,饱和KCl溶液的密度为1.174g/cm3,物质的量浓度为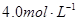 ,则下列说法中不正确的是
,则下列说法中不正确的是
A.25℃时,饱和KCl溶液的浓度大于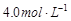
B.此溶液中KCl的质量分数为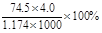
C.20℃时,密度小于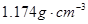 的KCl溶液是不饱和溶液
的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于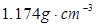
参考答案:D
本题解析:略
本题难度:简单
3、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
A.5.6g铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
B.2.24 L CO2中含有的原子数为0.3×6.02×1023
C.200 mL 5 mol·L-1 Na2CO3溶液中,含6.02×1023个CO32—
D.4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023
参考答案:D
本题解析:略
本题难度:简单
4、填空题 (1)44gCO2的物质的量为______;标准状况下其所占的体积为______;
(2)500mLNaOH溶液中含4gNaOH,则该溶液中c(NaOH)为______;
(3)0.4mol/L的Al2(SO4)3溶液200mL,则该溶液中c(SO
参考答案:(1)n(CO2)=44g44g/mol=1mol,V(CO2)=1mol×22.4L/mol=22.4L,故答案为:1mol;22.4L;
(2)n(NaOH)=4g40g/mol=0.1mol,c(NaOH)=0.1mol0.5L=0.2mol/L,故答案为:0.2mol/L;
(3)由物质的构成可知c(SO42-)=3×c(Al2(SO4)3)=3×0.4mol/L=1.2mol/L,故答案为:1.2mol/L;
(4)n(H2O)=9g18g/mol=0.5mol,含有的电子的物质的量为0.5mol×10=5mol,故答案为:5mol.
本题解析:
本题难度:一般
5、填空题 A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的 稀硫酸
稀硫酸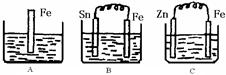
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A?;B?;C?。
(2)一段时间后,B中Sn极附近溶液的pH?(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度= ?mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为:?(填写序号) 。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是?(填写序号)。
参考答案:(1)A? Fe+2H+=Fe2++H2↑。B Fe-2e- ="==" Fe2+? C? 2H+ +2e- === H2↑
(2)pH增大?
(3)c(H2SO4)="?" 0.75? mol·L-1。? C> A= B
(4)由快到慢的顺序是? BAC
本题解析:略
本题难度:简单