时间:2025-06-25 22:08:47
1、选择题 在某一化学反应A + 2B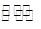 3C中,生成物B的浓度在10s内从1.5 mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为?
3C中,生成物B的浓度在10s内从1.5 mol/L变成2.0mol/L,则这10s内用生成物C的浓度变化表示的化学反应速率为?
A.0.05mol/(L·s)
B.0.05mol/L
C.0. 033 mol/(L·s)
D.0. 075 mol/(L·s)
2、选择题 下列反应中生成H2的速率最慢的是
[? ]
| 1 2 |
| a 6 |
| a 2 |
4、简答题 在2A(g)+B(g)
3C(g)+4D(g)中,下列情况能够降低该反应速率的是( )
A.升高温度
B.减小压强
C.使用正催化剂
D.增大A的浓度
5、选择题 下列说法正确的是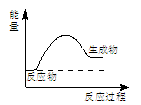
A.上图所示的是一个放热反应
B.加入催化剂v(正)增大、v(逆)减小
C.燃烧热是生成1molH2O放出的热量
D.只有活化分子才能发生有效碰撞