时间:2025-06-25 22:07:10
1、选择题 下列分子中,各原子未处于同一平面上的是
[? ]
A、NH3
B、C2H4
C、H2O
D、CH2O
参考答案:A
本题解析:
本题难度:简单
2、填空题 (每空2分,共12分)
现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。请回答下列问题: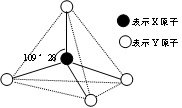
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式______?;同主族的第四周期元素基态原子的外围电子排布式为?。
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序:?。
(3)上述六种物质或粒子中互为等电子体的是?(写出化学式)。
(4)F分子的中心原子杂化类型是?,F易溶于E,其原因是?
? ________________?。
参考答案:(1)SiO2 + 2C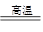 Si + 2CO ↑? 4S24P2?(2)N>O>C
Si + 2CO ↑? 4S24P2?(2)N>O>C
(3)CH4;NH4+?(4)SP3杂化,NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键
本题解析:能形成键角为109°28′的单质是金刚石,即A是碳,在高温下碳能和二氧化硅发生反应生成单质硅和CO。常温下呈液态的是水,则E是水,所以D是NH4+,F是氨气,C是甲烷。
(1)反应式为SiO2 + 2C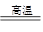 Si + 2CO ↑。第四周期第ⅣA元素是锗,其基态原子的外围电子排布式为4S24P2。
Si + 2CO ↑。第四周期第ⅣA元素是锗,其基态原子的外围电子排布式为4S24P2。
(2)处于同一周期的是C、N、O。非金属性越强第一电离能越大。但由于氮元素中2p轨道的单质是半充满状态,稳定性强,所以这三种元素第一电离能由大到小的顺序是N>O>C。
(3)电子数和原子数都相同的分子是等电子体,因此互为等电子体的是CH4和NH4+。
(4)氨气中中心原子的孤对电子是(5-1×3)÷2=1,所以是三角锥形结构,属于sp3杂化。由于NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键,属于氨气极易溶于水。
本题难度:一般
3、选择题 钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的结构示意图为下图,它的化学式是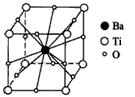
[ ? ]
A.BaTi8O12
B.BaTi4O6
C.BaTi2O4
D.BaTiO3
参考答案:D
本题解析:
本题难度:简单
4、填空题 X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与E的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)XZ2与YZ2分子的立体结构分别是____________和____________,相同条件下两者在水中的溶解度较大的是____________(写分子式),理由是____________;
(2)Q的元素符号是____________,它的外围电子排布式为____________,在形成化合物时它的最高化合价为____________;
(3)用氢键表示式写出E的氢化物溶液中存在的所有氢键____________。
参考答案:(1)V形;直线形;SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,
SO2在H2O中的溶解度较大
(2)Mn;3d54s2;+7
(4)F-H…F F-H…O O-H…F O-H…O
本题解析:
本题难度:一般
5、选择题 某晶体的粒子结构如图5—10所示:正六面体的8个顶点上为A粒子,12个棱的中点上为B粒子,6个面的中心上为C粒子,六面体的中心上为D粒子。那么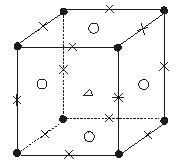
图5—10
该晶体中A、B、C、D 4种粒子的个数比为(?)
A.1∶3∶3∶1? B.3∶1∶3∶1
C.1∶1∶3∶3? D.1∶3∶1∶3
参考答案:A
本题解析:略
本题难度:简单