时间:2025-06-25 22:04:42
1、选择题 下列过程中△H大于零的是?(?)
A.乙醇燃烧
B.酸碱中和反应
C.碳酸钙分解得二氧化碳
D.实验室制备氢气
参考答案:C
本题解析:A乙醇燃烧是放热反应,△H小于零
B酸碱中和反应是放热反应,△H小于零
C.碳酸钙分解得二氧化碳是吸热反应,△H大于零
D. 实验室制备氢气是放热反应,△H小于零。
本题难度:简单
2、选择题 下列各图象中,不正确的是( )
A.
N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ/mol
B.
向弱酸HA的稀溶液中加水稀释
C.
有催化剂(a)和无催化剂(b)时反应的能量变化
D.
向NH4Al(SO4)2溶液中滴加过量NaOH溶液
参考答案:A、温度升高,反应速率增大,到达平衡用的时间少,反应曲线的斜率大,并且该反应为放热反应,升高温度平衡向逆反应方向移动,氨气的含量降低,故A错误;
B、向弱酸HA的稀溶液中加水稀释,促进弱酸的电离,平衡向正反应方向移动,则n(A-)增加,n(HA)减少,根据
c(A-)c(HA)=n(A-)n(HA)可知加水稀释时c(A-)c(HA)增大,故B正确;
C、催化剂降低反应的活化能,故C正确;
D、向NH4Al(SO4)2溶液中滴加过量NaOH溶液,首先发生反应为Al3++3OH-═Al(OH)3,当沉淀完全时,NH4+与OH-离子发生反应:NH4++OH-═NH3?H2O,此时沉淀的质量不变,继续加NaOH,之后Al(OH)3继续与OH-离子反应:Al(OH)3+OH-═AlO2-+2H2O,故D正确;
故选A.
本题解析:
本题难度:一般
3、选择题 下列说法中错误的是
[? ]
参考答案:B
本题解析:
本题难度:简单
4、简答题 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式______;
(2)PCl5分解生成PCl3和Cl2的热化学方程式______;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol?PCl5,反应达到平衡时还剩余0.6mol?PCl5,其分解率α1等于______;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2______α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是______;
(4)P和Cl2分两步反应生成1mol?PCl5的△H3=______;P和Cl2一步反应生成1mol?PCl5的△H4______△H3(填“大于”、“小于”或“等于”),原因是______.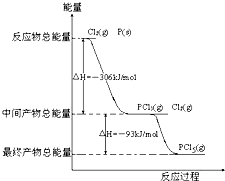
参考答案:(1)热化学方程式书写要求:注明各物质的聚集状态,判断放热反应还是吸热反应,反应物的物质的量与反应热成对应的比例关系,根据图示P(s)+Cl2(g)→PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,热化学方程式为P(s)+32Cl2(g)═PCl3(g);△H=-306 kJ/mol,
即2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol,故答案为:2P(s)+3Cl2(g)=2PCl3(g)△H=-612kJ/mol;?
(2)△H=生成物总能量-反应物总能量,Cl2(g)+PCl3(g)=PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,所以 PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;热化学方程式为PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol,PCl5分解率α1=0.8-0.60.8×100%=25%.PCl5(g)=PCl3(g)+Cl2(g)是吸热反应;升高温度向吸热反应方向移动,正反应(分解反应是吸热反应)是吸热反应,升高温度向正反应方向移动,转化率增大,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ?mol-1;25%;大于;?
(3)Cl2(g)+PCl3(g)=PCl5(g),是放热反应,降温平衡向放热反应方向移动,降温有利于PCl5(g)的生成,
故答案为:因为PCl5分解反应是吸热反应,温度太高,不利于PCl5的生成;
(4)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
2P(s)+3Cl2(g)=PCl3(g);△H1=-612 kJ/mol,
Cl2(g)+PCl3(g)=PCl5(g);△H2=-93 kJ/mol;
P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol,根据盖斯定律:化学反应不管是一步完成,还是分步完成,化学反应的焓变是一样的,
故答案为:-399kJ/mol;等于;根据盖斯定律可知,如果一个化学反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的.
本题解析:
本题难度:一般
5、选择题 下列热化学方程式正确的是( )
A.2SO2+O2 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.C(g)+O2(g)=CO(g) ΔH=393.5 kJ·mol-1
C.H2(g)+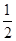 O2(g)=H2O(g) ΔH=-241.8 kJ
O2(g)=H2O(g) ΔH=-241.8 kJ
D.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
参考答案:D
本题解析:A、未写出物质的聚集状态,错误;B、ΔH未标明“+”“-”号,不能判断反应为吸热还是放热反应,错误;C、反应热的单位是kJ/mol,错误;D、符合热化学方程式的书写,正确,答案选D。
本题难度:一般