时间:2025-06-25 22:03:51
1、选择题 下列分子中所有原子都满足最外层8电子结构的是
A.CH3Br
B.SF6
C.CCl4
D.BF3
参考答案:C
本题解析:只要含有氢原子,其最外层就不可能满足8电子结构。B中硫原子已经达到12个电子。D中B原子是6个电子的,只有选项C正确。即如果该元素的化合价的绝对值和最外层电子数之和满足8,那么该原子的最外层就满足8电子结构。答案是C。
本题难度:一般
2、填空题 (6分) A质子数、B中子数、C质子数和中子数、D最外层电子数、E电子层数,请用单个序号填写下列各空白。
A质子数、B中子数、C质子数和中子数、D最外层电子数、E电子层数,请用单个序号填写下列各空白。
元素的种类由(1)决定;元素的化学性质主要由(2)决定;是否是同位素由(3)决定。
参考答案:(6分)A ;D ;C 。
本题解析:略
本题难度:简单
3、选择题 门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si________Ge(用“>”或“<”表示)。
②若锗位于硅的下一周期,写出“锗”在周期表中的位置________。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是________。
③硅和锗单质分别与H2反应时,反应较难进行的是________(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试从原子结构的角度解释镓与铝性质相似的原因________________。冶炼金属镓通常采用的方法是________________。
②为判断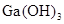 是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________。
是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________。
参考答案:(1)①>?第四周期ⅣA族 ② 半导体材料 ③ 锗
(2)① 它们的原子最外层电子数都为3?电解法
② 氢氧化钠溶液?稀硫酸或盐酸
本题解析:本体主要考察元素周期表及元素周期律相关内容。
(1)①由于元素锗最高价化合物为﹢4价,故其位于元素周期表中第四主族,与硅同一主族,且硅最高价氧化物对应的水化物为酸性,锗的最高价氧化物对应水化物为两性,故硅的非金属性大于锗。
② 硅位于第三周期第四主族,锗与硅同一主族,而锗位于第四周期,所以锗在元素周期表的位置为第四周期ⅣA族。?锗与硅同为半导体材料。
③非金属性越强,单子越容易与氢气发生反应,同主族元素随原子序数增大,非金属性渐弱,故硅的非金属性强于锗的非金属性。硅与氢气更容易化合。
(2)① 二者位于同一主族,最外层电子数相同,均为3个。?镓比较活泼,故采用电解法。
②判断物质是否具有两性可观察该物质是否与酸、碱都发生反应。
本题难度:一般
4、选择题 欧洲科学家将62Ni和208Pb经核聚变并释放出1个中子后,生成一种新的核素 。该原子的原子核内中子数为(?)
。该原子的原子核内中子数为(?)
A.110
B.159
C.161
D.269
参考答案:B
本题解析:考查原子的组成及原子组成的表示方法。表示原子组成时在元素符号的左下角标明质子数,左上角注明质量数。因为质子数和中子数之和是质量数,所以该原子的中子数为269-110=159.答案选B。
本题难度:简单
5、填空题 下表为周期表的一部分,其中的编号代表对应的元素。
试填空。
(1)写出上表中元素I的基态原子的电子排布式和价层电子排布图:________________________________________________________________________。
元素C、D、E、F的第一电离能由大到小的顺序是________(用元素符号表示)。
(2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有________。
A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形
B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式
C.三种分子中键角由大到小的顺序是丙>乙>甲
D.甲、乙和丙分子均为由极性键构成的极性分子
(3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断:
①该化合物的晶体类型为________。
②该化合物的晶体中存在的作用力有________。
A.离子键?B.极性键
C.非极性键?D.范德华力
E.氢键? F.配位键
③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为________。
(4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是________________________________________________。
(5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是_____________________________________________________________。
参考答案:(1)1s22s22p63s23p63d54s1(或[Ar]3d54s1)  ?F>N>O>C
?F>N>O>C
(2)CD
(3)①分子晶体 ②BDF ③1∶2
(4)氟化氢气体中存在因氢键而相互缔合形成的缔合分子(HF)n
(5)Be与Al在元素周期表中位于对角线的位置
本题解析:根据这几种元素在周期表中的位置推知:A为H(氢),B为Be,C为C(碳),D为N,E为O,F为F(氟),G为Al,H为Cl,I为Cr,J为Fe,(1)Cr元素基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,其价层电子排布图为 ,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能,因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。
,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能,因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。
本题难度:困难