时间:2025-06-25 21:59:00
1、选择题 2010年2月19日,德国重离子研究中心宣布,经国际纯粹与应用化学联合会(IUPAC)确认,由该中心人工合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”,以纪念著名天文学家哥白尼。下列关于Cn的说法不正确的是( )
A、该元素原子核外有七个电子层
B、该元素既属于超铀元素,又属于主族元素
C、若一个Cn原子的质量约为氕原子质量的277倍,则该原子可表示为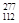 Cn
Cn
D、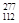 Cn与
Cn与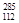 Cn互为同位素,二者中子数之差为8
Cn互为同位素,二者中子数之差为8
2、填空题 在真空中将一种晶体物质A加热到200℃时,即产生4种气体B、C、D、E,它们的物质的量之比为1∶1∶1∶1,冷却到0℃时生成另一种晶体物质K,此时4种气体中有一种没有参加反应,该气体相对氢气的密度为14。各物质之间有如图所示的转化关系,其中F、H为单质,其余为化合物,C为无色液体,G为淡黄色粉末状固体,E与H的相对分子质量相等。根据上述信息回答下列问题:
(1)写出A的化学式 。写出A的名称?。
(2)写出B分子的空间构型 ,写出G的电子式?
(3)写出反应②的化学方程式?。
(4)写出物质K与足量的I溶液在加热的条件下反应的离子方程式:?
?
3、填空题 (6分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称)?,以下三种说法中,可以验证该结论的是(填写编号)?;
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为?。
(3)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为___________。
4、选择题 不合格建筑石材含有放射性的 。该原子的中子数是
。该原子的中子数是
A.50
B.86
C.136
D.222
5、选择题 天然存在的金属钫(Fr)极少,它的21种已知同位素都具有放射性。它是碱金属元素中最重的元素。根据周期律知识和碱金属的性质预言其性质,其中不正确的是(?)
A.在已知元素中具有最大的原子半径
B.在空气中充分燃烧时生成氧化物Fr2O
C.最高价氧化物对应的水化物是极强的碱
D.其单质的熔点比金属钠的熔点低