时间:2025-06-25 21:54:52
1、选择题 将BaCl2溶液分盛两支试管,第1支加入HNO3,第2支加入烧碱溶液,然后再分别通入SO2气体,结果两试管均有白色沉淀产生。下列说法正确的是?(?)
A.证明SO2具有强氧化性和酸性
B.若第1支试管改通H2S或Cl2溶解,后再通SO2气体,均不会产生沉淀
C.若第2支试管改通NH3,后通SO2,不会产生沉淀
D.升高pH使SO2水溶液中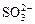 浓度增大
浓度增大
参考答案:D
本题解析:略
本题难度:简单
2、实验题 某课外兴趣小组为探究铜跟浓硫酸反应情况,用下图所示装置进行实验。已知:①SO2难溶于饱和亚硫酸氢钠溶液;②SO2能与酸性高锰酸钾溶液发生氧化还原反应使之褪色(化学方程式为5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4)。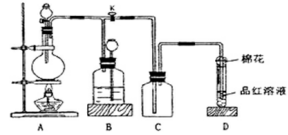
回答下列问题(注:E为止水夹,F为旋塞):
(1)检查A装置的气密性的方法?。
(2)装置A中反应的化学方程式为?。
(3)装置D中试管口放置的棉花应蘸有NaOH溶液,
其作用是?。
(4)装置B具有贮存气体的作用。当D处有明显的现象后,关闭旋塞F并移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中的现象是?,B中应放置的液体是(填字母)?。
A.水
B.饱和NaHSO3溶液
C.酸性KMnO4溶液
D.NaOH溶液
(5)该小组学生做了如下实验:取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中没有铜片剩余。往反应后的溶液中加入足量的BaCl2溶液,获得沉淀3.495 g;产生的气体恰好使200ml 0.01mol·L-1的酸性高锰酸钾溶液褪色,则实验中取用的硫酸的物质的量为?。
参考答案:(1)夹紧水夹E,关闭分液漏斗旋塞,往分液漏斗中加水,打开分液漏斗旋塞,若漏斗中水滴入部分后便停止,证明气密性好。若水一直滴入,则气密性不好。
(2)H2SO4(浓)+Cu CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)吸收尾气中SO2,防止污染;
(4)瓶中液面下降,漏斗中液面上升; B
(5)0.02mol;
本题解析:(1)检查A装置的气密性的方法是夹紧水夹E,关闭分液漏斗旋塞,往分液漏斗中加水,打开分液漏斗旋塞,若漏斗中水滴入部分后便停止,证明气密性好。若水一直滴入,则气密性不好。(2)在装置A浓 与Cu发生反应,化学方程式为H2SO4(浓)+Cu CuSO4+SO2↑+2H2O. (3)SO2是大气污染物,如不处理,容易导致大气污染。所以在装置D中试管口放置的棉花应蘸有NaOH溶液,其作用是吸收尾气中SO2,防止污染;(4)装置B具有贮存气体的作用。当D处有明显的现象后,关闭旋塞F并移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中的现象是瓶中液面下降,漏斗中液面上升至一定的高度。由于SO2难溶于饱和亚硫酸氢钠溶液; SO2能与酸性高锰酸钾溶液发生氧化还原反应使之褪色,而且容易溶解在水中。所以B中应放置的液体是饱和NaHSO3溶液。选项为B。根据S守恒可得n(H2SO4)=n(SO42-)+n(SO2)。n(SO42-)=3.495 g÷233g/mol=0.015mol;根据方程式5SO2+ 2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4可得n(SO2)= 5/2×n(KMnO4)= 5/2×0.2L×0.01mol/L=0.005mol.所以n(H2SO4)=0.02mol。
CuSO4+SO2↑+2H2O. (3)SO2是大气污染物,如不处理,容易导致大气污染。所以在装置D中试管口放置的棉花应蘸有NaOH溶液,其作用是吸收尾气中SO2,防止污染;(4)装置B具有贮存气体的作用。当D处有明显的现象后,关闭旋塞F并移去酒精灯,由于余热的作用,A处仍有气体产生,此时B中的现象是瓶中液面下降,漏斗中液面上升至一定的高度。由于SO2难溶于饱和亚硫酸氢钠溶液; SO2能与酸性高锰酸钾溶液发生氧化还原反应使之褪色,而且容易溶解在水中。所以B中应放置的液体是饱和NaHSO3溶液。选项为B。根据S守恒可得n(H2SO4)=n(SO42-)+n(SO2)。n(SO42-)=3.495 g÷233g/mol=0.015mol;根据方程式5SO2+ 2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4可得n(SO2)= 5/2×n(KMnO4)= 5/2×0.2L×0.01mol/L=0.005mol.所以n(H2SO4)=0.02mol。
本题难度:一般
3、选择题 下列化合物不能由单质间直接化合生成的是( )?
A.Cu2S
B.Fe2S3
C.HgS
D.Fe3O4?
参考答案:B
本题解析:S氧化性弱,不能将Fe、Cu氧化到+3、+2价,Cu2S能由单质化合生成,Fe2S3不能。Hg虽有变价,但S可将Hg氧化到+2价。Fe3O4是Fe在氧气中燃烧的产物。
本题难度:简单
4、选择题 下列物质①NaOH、②氯水、③空气、④氢硫酸、⑤Na2SO3、⑥Na2CO3,其中能与SO2在一定条件下发生反应的是(? )
A.①②④⑤
B.②④⑤⑥
C.②③④⑤
D.全部
参考答案:D
本题解析:①SO2+2NaOH Na2SO3+H2O或NaOH+SO2
Na2SO3+H2O或NaOH+SO2 NaHSO3?②Cl2+SO2+2H2O
NaHSO3?②Cl2+SO2+2H2O H2SO4+2HCl?③2SO2+O2
H2SO4+2HCl?③2SO2+O2 2SO3?④2H2S+SO2
2SO3?④2H2S+SO2 3S↓+2H2O?⑤Na2SO3+SO2+H2O
3S↓+2H2O?⑤Na2SO3+SO2+H2O 2NaHSO3?⑥Na2CO3+SO2
2NaHSO3?⑥Na2CO3+SO2 Na2SO3+CO2。
Na2SO3+CO2。
本题难度:简单
5、填空题 假设116号元素存在,完成下列问题:?
(1)116号元素在元素周期表中的位置是___________________________________。?
(2)下列关于116号元素的说法中正确的是_________________。?
A.无氧酸钠盐的化学式为Na2R的形式?
B.最高价氧化物可能是碱性氧化物?
C.原子的近似相对原子质量必定为332?
参考答案:(1)第七周期、ⅥA族 (2)B
本题解析:已知元素的原子序数判断元素在周期表中的位置,方法之一是参照ⅠA族和0族元素原子序数法。元素周期表第七周期的ⅠA族元素原子序数为87,0族元素原子序数为118,87<116<118。故116号元素在周期表的第七周期、倒数第三个族——ⅥA族。
周期表第ⅥA族第五周期的元素碲虽然为非金属元素,但有一定的金属性,如单质碲为银白色、能导电。根据周期表同主族内元素性质变化的规律判断可知,116号元素是金属元素,且其金属性较强或很强。金属元素的最高价氧化物可能是碱性氧化物,但它不存在无氧酸,自然就没有Na2R这种形式的盐。
原子的近似相对原子质量就是原子的质量数。元素原子序数是116,该元素中可能有同位素,或者说该元素可能包括两种或更多种不同的核素。在现有条件下,不能确定该元素中任何一种核素原子核内的中子数,也就不能确定原子的近似相对原子质量。
本题难度:简单