时间:2025-06-25 21:54:01
1、选择题 下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )
①蒸发?②蒸馏?③过滤?④萃取.
A.①
B.③④
C.④
D.②③
2、选择题 下列说法中正确的是( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.乙醇和水的混合溶液可用分液漏斗进行分离
C.分液漏斗在使用之前要检查是否漏气
D.分液时,先将下层液体从分液漏斗下口放出,再将上层液体从上口倒出
3、实验题 某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。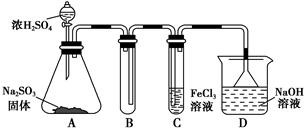
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 ? b.烧杯 ? c.石棉网 ? d.玻璃棒 ? e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4?b.酸性KMnO4溶液
c.碘水?d.NaCl溶液
4、选择题 下列鉴别方法可行的是(? )
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32-
C.菠菜中铁元素含量较高,为证明菠菜中的铁元素是+2价还是+3价,可把菠菜捣碎加水溶解,再向过滤后的滤液中加硫氰化钾溶液
D.加入稀盐酸产生使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32-
5、选择题 下列根据实验操作和现象所得出的结论正确的是(?)
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3 溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | SO2具有漂白性 |
| C | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无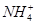 |
| D | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)> Ksp(AgI) |