时间:2025-06-25 21:53:17
1、填空题 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇:
( CO2 + 3H2 = CH3OH + H2O ),并开发出直接以甲醇为燃料的燃料电池。
已知 H2(g)、 CO(g) 和 CH3OH(l) 的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是________(填序号)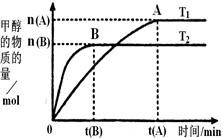
①温度为T1时,从反应开始到平衡,生成甲醇的
平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时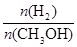 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 ( 用 a表示 )
(4)已知甲醇燃烧的化学方程式为2CH3OH +3O2 =2CO2 +4H2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为
参考答案:(1) 2858 ;(2) ③④ ; (3) 1-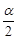 (或(2- a)/ 2 );
(或(2- a)/ 2 );
(4)CH3OH + H2O- 6e-= CO2 + 6H+ ;O2 + 4H+ + 4e-= 2H2O
本题解析:(1)由于H2(g)的燃烧热△H分别为-285.8 kJ·mol-1,所以产生1mol的水时放出热量是285.8 kJ,因此若用太阳能分解10mol水消耗的能量是285.8 kJ×10=2858KJ;(2) ①速率是单位时间内的浓度改变数值,定义应用不对,错误;②由于在温度为T1时甲醇的平衡物质的量浓度大于T2时,说明该反应在T1时的平衡常数比T2时的大,错误;③H2(g)、 CO(g) 和 CH3OH(l) 的燃烧热的热化学方程式是H2(g)+1/2O2(g)= H2O(l) ΔH=-285.8 kJ/mol; CO(g)+ 1/2O2(g)= CO2(g)ΔH=-283.0 kJ/mol; CH3OH(l) + 3/2O2(g)= CO2(g)+ 2H2O(l) ΔH=-726.5 kJ/mol;将氢气燃烧热的方程式扩大3倍与甲醇的燃烧热方程式相减,整理可得CO2(g)+ 3H2(g)= CH3OH (g)+ H2O(g)ΔH=-130.9KJ/mol,所以该反应为放热反应,正确;④由于该反应是反应反应,所以升高温度,平衡逆向移动,甲醇的含量降低,因此温度T2>T1,处于A点的反应体系从T1变到T2,达到平衡时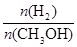 增大,正确;(3)在恒容密闭容器内发生的反应,气体的物质的量的比等于容器内气体的压强之比,在反应开始时,容器内气体的物质的量是4mol,由于CO2转化率为a,则达到平衡时各种气体的物质的量分别是H2:(3-3a)mol; CO2; (1-a)mol; CH3OH: amol; H2O:amol;平衡时气体的物质的量是(4-4a)mol;故此时的压强与开始的压强之比是:(4-4a)÷4=1-
增大,正确;(3)在恒容密闭容器内发生的反应,气体的物质的量的比等于容器内气体的压强之比,在反应开始时,容器内气体的物质的量是4mol,由于CO2转化率为a,则达到平衡时各种气体的物质的量分别是H2:(3-3a)mol; CO2; (1-a)mol; CH3OH: amol; H2O:amol;平衡时气体的物质的量是(4-4a)mol;故此时的压强与开始的压强之比是:(4-4a)÷4=1-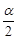 ;(4)已知甲醇燃烧的化学方程式为2CH3OH +3O2 =2CO2 +4H2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极甲醇的反应式为CH3OH + H2O- 6e-= CO2 + 6H+;正极的反应式为O2 + 4H+ + 4e-= 2H2O。
;(4)已知甲醇燃烧的化学方程式为2CH3OH +3O2 =2CO2 +4H2O ,在直接以甲醇为燃料电池中,电解质溶液为酸性,负极甲醇的反应式为CH3OH + H2O- 6e-= CO2 + 6H+;正极的反应式为O2 + 4H+ + 4e-= 2H2O。
考点:考查盖斯定律的应用、外界条件对可逆反应的平衡的影响、容器内气体的压强的比例关系、原电池反应原理的应用的知识。
本题难度:困难
2、选择题 下列叙述不正确的是
A.氨气变成液氨的过程中,熵值减小,同时向环境释放能量
B.废旧电池必须回收处理,防止电池中含有的汞、铅、镉等金属污染环境
C.pH=5的盐酸,稀释1000倍后,溶液pH约为8
D.离子化合物中一定含有离子键,可能还含有共价键
参考答案:C
本题解析:在pH=5的盐酸溶液中,可以忽略掉水电离出的氢离子。但是将其稀释1000倍后,就不能忽略水电离出的氢离子了。所以,酸性溶液加水稀释,每稀释10n倍,pH增加n,但最终不大于7。
本题难度:一般
3、选择题 用盐酸测定碳酸钠时既可用酚酞作指示剂又可用甲基橙(一种酸碱指示剂)作指示剂,现分别用酚酞和甲基橙作指示剂,用0.1000mol/L的HCl滴定20.00mL的纯碱溶液,滴定终点时分别用去了20.00mL、40.00mL的盐酸,下列说法中不正确的是? (? )
A.用酚酞作指示剂时滴定的总反应为:Na2CO3+HCl=NaHCO3+NaCl
B.用甲基橙作指示剂时滴定的总反应为:Na2CO3+2HCl=NaCl+CO2↑+H2O
C.可用碱式滴定管量取所需要的Na2CO3溶液
D.若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏低
参考答案:D
本题解析:分别用酚酞和甲基橙作指示剂,用0.1000mol/L的HCl滴定20.00mL的纯碱溶液,滴定终点时分别用去了20.00mL、40.00mL的盐酸,说明用酚酞作为指示剂,滴定的结果生成了NaHCO3,而用甲基橙作为指示剂,滴定的结果生成了NaCl,故AB正确;Na2CO3溶液显示出碱性,故可以用碱式滴定管量取;故C正确;若酸式滴定管没有用标准溶液润洗,则所测得的碳酸钠溶液浓度偏高,故D的说法是错误的,为本题的正确选项。
点评:本题考查了滴定的指示剂,该题可以扩展学生的视野,即采用不同的指示剂,滴定终点的产物有可能是不同的,本题难度适中。
本题难度:一般
4、填空题 (16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格。
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml | ? |
 H++In—。则酸根离子In—的颜色是?。甲基橙的酸性与草酸相比,?(填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是?。甲基橙的酸性与草酸相比,?(填前者强、前者弱、十分接近、无法判断)。
参考答案:(1)40 s (2分)
(2)黄色?前者弱(各2分)
(3)如图(3分,起点、终点各1分,斜率1分)
(4)MgCl2与(NH4)2C2O4恰好完全反应,但有
MgC2O4(s) Mg2+(aq)+C2O42-(aq),c(Mg2+)·c(C2O42-)=Ksp=8.1×10-5,
Mg2+(aq)+C2O42-(aq),c(Mg2+)·c(C2O42-)=Ksp=8.1×10-5,
而c(Mg2+)=c(C2O42-),
c(Mg2+)=(8.1×10-5)-1/2=9×10-3 mol/L>10-5 mol/L
故Mg2+未沉淀完全。(4分)
(5)ABCD (3分,选对1个得1分,选对2个得2分,选对3个以上得3分)
本题解析:(1)反应速率与反应物的浓度有关,与反应物的物质的量多少无关,草酸和高锰酸钾的浓度并没有发生变化,而且温度也没有改变,所以反应速率是不变的,即褪色时间是不变的。
(2)甲基橙的变色范围是3.1~4.4,小于3.1时显红色,大于4.4时显黄色。根据甲基橙的电离方程式可知,当溶液碱性增强时平衡是向正反应方向移动的,所以该酸根的颜色是显黄色的。因为草酸钠溶液水解显碱性,此时甲基橙显黄色。若草酸的酸性弱于甲基橙的,则在草酸溶液中甲基橙显黄色,所以通过颜色的变化无法判断滴定终点。因此草酸的酸性要强于甲基橙的,这样在滴定过程中颜色才能发生变化。
(3)盐酸是强酸,草酸是弱酸,存在电离平衡,所以在稀释过程中盐酸中氢离子的浓度始终小于草酸中氢离子的浓度。但当无限稀释时二者的PH均要无限接近7。
(4)1 L0.01 mol/LMgCl2溶液中的Mg2+的物质的量是0.01mol,100 mL0.1 mol/L的(NH4)2C2O4溶液的物质的量也是0.01mol,即二者恰好反应。根据溶解平衡MgC2O4(s) Mg2+(aq)+C2O42-(aq)可知c(Mg2+)·c(C2O42-)=Ksp=8.1×10-5
Mg2+(aq)+C2O42-(aq)可知c(Mg2+)·c(C2O42-)=Ksp=8.1×10-5
因为c(Mg2+)=c(C2O42-),所以c(Mg2+)=(8.1×10-5)-1/2=9×10-3 mol/L>10-5 mol/L
故Mg2+未沉淀完全。
(5)常温下由水电离出的c(H+)=1.0×10-5mol/L,说明该溶液中水的电离是被促进的,若只有阳离子水解,则溶液显酸性,即此时溶液的pH为5。若只有阴离子水解,则溶液显碱性,此时溶液中的c(OH-)=1.0×10-5mol/L,则溶液中的c(H+)=1.0×10-9mol/L所以溶液的pH是9。若溶液阴离子和阳离子同时都水解。若阳离子的水解程度大于阴离子的水解程度,则溶液显碱性;若阳离子的水解程度小于阴离子的水解程度,则溶液显酸性;阳离子的水解程度和阴离子的水解程度相同,则溶液显中心,所以选项A、B、C、D均正确。
本题难度:一般
5、计算题 取体积相同的两份0.1mol·L-1的NaOH溶液把其中的一份敞口放在空气中一段时间后,溶液的pH将______(填增大、减小或不变)。用已知浓度的H2SO4溶液去中和两份NaOH溶液时,若中和在空气中放置的溶液所消耗H2SO4溶液体积为V1,另一份消耗H2SO4溶液体积为V2。
(1)以甲基橙为指示剂时,V1和V2的关系是______。
(2)以酚酞作为指示剂时,V1和V2的关系是______。
参考答案:变小?①V1=V2?②V1<V2
本题解析:一份NaOH溶液暴露在空气中,会吸收空气中的CO2气体而转化为Na2CO3,方程式为2NaOH+CO2====Na2CO3+H2O。由于消耗了NaOH,则溶液的pH会减小,该溶液中的溶质为NaOH和Na2CO3,另一份溶液的溶质仍为NaOH。
(1)若以甲基橙为指示剂,变色时溶液呈酸性,则Na2CO3与H2SO4反应转变为CO2溶解在H2O中生成H2CO3而使溶液呈酸性。由于1mol NaCO3由2mol NaOH转变而来,而此时1mol Na2CO3消耗的H2SO4与2mol NaOH消耗的H2SO4相等,所以,V1=V2。
(2)若以酚酞为指示剂,变色时溶液呈弱碱性,Na2CO3与H2SO4反应后应生成NaHCO3,由于NaHCO3溶液中HCO3-水解生成OH-的能力大于HCO3-电离生成H+的能力,从而使溶液呈弱碱性。由于1mol Na2CO3转变为NaHCO3消耗的H2SO4少于2mol NaOH转变为Na2SO4消耗的H2SO4少,所以V1<V2。
本题难度:一般