时间:2025-06-25 21:44:17
1、简答题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH 甲 0.2 0.2 pH=a 乙 c 0.2 pH=7 丙 0.2 0.1 pH>7 丁 0.1 0.1 pH=9 |
参考答案:(1)一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度都为0.2mol/L,则酸碱的物质的量相等,如a=7,说明反应后溶液呈中性,则HA是强酸,如a>7,反应后呈碱性,则HA是弱酸,
故答案为:a=7,a>7;
(2)反应后溶液呈中性,如HA为强酸,则c=0.2,如HA为弱酸,则c>0.2,仅从乙组情况分析,c不一定等于0.2,
由于反应后溶液呈中性,则有c(OH-)=c(H+),根据溶液呈中性,则有c(Na+)+c(H+)=c(A-)+c(OH-),
所以c(A-)=c(Na+),故答案为:否;c(A-)=c(Na+);
(3)等物质的量的酸碱反应后溶液呈碱性,由于NaOH为强碱,则该酸为弱酸,在溶液中存在A-+H2O?HA+OH-,则
c(Na+)>c(A-),溶液呈碱性,则c(OH-)>c(H+),一般来说,盐类的水解程度较低,则有c(A-)>c(OH-),所以有:c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:弱;c(Na+)>c(A-)>c(OH-)>c(H+).
(4)溶液的pH=9,则氢离子浓度为10-9 mol/L,等物质的量的酸碱反应后溶液呈碱性,溶液中氢氧根离子全部来自于弱酸根离子水解得到的,c(OH-)=KwC(H+)=10-1410-9mol/L=10-5 mol/L.
故答案为:10-5.
本题解析:
本题难度:一般
2、选择题 下列叙述中因果关系成立的是
A.因为NH3的水溶液可以导电,所以NH3是电解质
B.因为SO2可以使溴水褪色,所以SO2具有漂白性
C.因为加热后纯水的pH<7,所以升温可使水呈酸性
D.因为电解质溶于水后发生电离,所以电解质在溶液中的反应实质是离子间的反应
参考答案:D
本题解析: A.电解质必须是本身电离出的离子导电,NH3的水溶液可以导电,是因为氨气和水发生了反应生成一水合氨,一水合氨电离出离子导电,所以一水合氨是电解质,NH3不是电解质,错误;B.SO2和溴水发生了氧化还原反应而使其褪色,SO2体显了还原性,错误; C.加热后纯水的电离程度增大,电离平衡常数KW增大,溶液中氢离子和氢氧根离子浓度都增大,但两者浓度相等,虽然pH<7,但仍为中性,错误; D正确。
本题难度:一般
3、选择题 下列电解质在水溶液中电离方程式错误的是( )
A.NaHCO3===Na++H++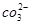
B.NaHSO4===Na++H++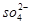
C.MgCl2===Mg2++2Cl-
D.Ba(OH)2===Ba2++2OH-
参考答案:A
本题解析:考查电离方程式的正误判断。碳酸氢钠的电离方程式应该是NaHCO3=Na++HCO3-,即选项A不正确,其余选项都是正确的,答案选A。
本题难度:简单
4、选择题 常温离子液体(Ionic?Liquid)也称常温熔融盐.硝酸乙基铵〔(C2H5NH3)NO3〕是人类发现的第一种常温离子液体,其熔点为12℃.已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是( )
A.可用作电池的电解质
B.水溶液呈碱性
C.是共价化合物
D.结构和性质类似于硝酸乙酯
参考答案:A、因硝酸乙基铵〔(C2H5NH3)NO3〕为离子液体,含自由离子的化合物可作为电解质,故A正确;
? B、因硝酸乙基铵〔(C2H5NH3)NO3〕是一种强酸弱碱盐,硝酸乙基铵〔(C2H5NH3)NO3〕在水溶液中电离产生C2H5 NH3+?NO3-,C2H5 NH3+?发生水解生成(C2H5NH3)OH和H+,水溶液呈酸性,故B错误;
? ?C、因硝酸乙基铵〔(C2H5NH3)NO3〕为常温熔融盐,由是C2H5NH3+?和NO3-构成,属于离子化合物,故C错误;
? D、因硝酸乙基铵〔(C2H5NH3)NO3〕为离子化合物,而硝酸乙酯〔(CH3CH20NO2〕是共价化合物,这两种物质的结构不同,所以性质也不同,故D错误;
? 故选:A.
本题解析:
本题难度:简单
5、选择题 下列叙述正确的是?
[? ]
A.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]<?c(NH4Cl)
B.中和相同体积、相同pH的①硫酸、②盐酸和③醋酸所需相同浓度的NaOH溶液的体积关系:V1>V2=V3
C.0.2?mol·L-1?HCl溶液与等体积0.05?mol·L-1?Ba(OH)2溶液混合后,溶液的pH=1
D.已知难溶物FeS的Ksp?=?8.1×10-17,FeS饱和溶液中c(H+)2·c(S2-)?=?1.0×10-22,为使溶液里c(Fe2+)达到了1mol/L,应调节溶液中的c(H+)为1.11×10-3mol/L
参考答案:D
本题解析:
本题难度:一般