时间:2025-06-25 21:42:35
1、选择题 在指定环境中,下列各组离子一定可以大量共存的是(?)
A.使pH试纸呈红色的溶液: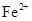 、
、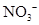 、
、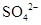 、
、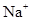
B.常温下,在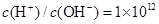 的溶液:
的溶液: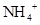 、
、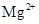 、
、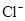 、
、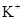
C.加入铝粉放出氢气的溶液: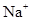 、
、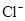 、
、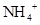 、
、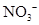
D.使无色酚酞试液显红色的溶液: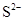 、
、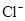 、
、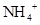 、
、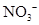
2、选择题 将5mL0.4mol/LAgNO3溶液与10 mL 0.3mol/LBaCl2溶液混合,反应后,溶液中离子浓度最大的是
A.Ag+
B.NO3-
C.Ba2+
D.Cl-
3、选择题 若在加入铝粉能放出H2的溶液中分别加入下列各组离子,肯定不能共存的是(? )
A.Fe2+、NO、Cl-、Na+
B.Ba2+、Mg2+、CO、SO
C.NO、Na+、K+、CO
D.NO、K+、CO、OH-
4、选择题 下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl?、S2?
B.酸性溶液中可能大量存在Na+、ClO?、SO42?、I?
C.弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3?
D.中性溶液中可能大量存在Fe3+、K+、Cl?、SO42?
5、选择题 下列说法正确的是(?)
A.pH=2的H2SO4与pH=1的硝酸溶液中c(H+)之比为1∶10
B.0.2 mol·L-1与0.1 mol·L-1醋酸中c(H+)之比为2∶1
C.100 ℃时,纯水的pH=6,显酸性
D.100 mL,pH=3的盐酸和醋酸溶液,分别与足量锌反应后,所得H2的质量相等