时间:2025-06-25 21:41:50
1、填空题 (15分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语
回答下列问题: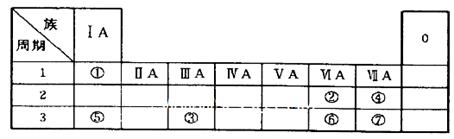
(1)④、⑤、⑦的原子半径由大到小的顺序为_______(用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为_______>_______。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe+氧化,写出该反应的离子方程式_______。
(4)由表中元素形成的物质可发生如图中的反应,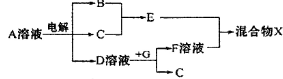
其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式______________.
②写出检验A溶液中溶质的阴离子的方法:______________.
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为_______mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有_______ 。
2、选择题 由于镁燃烧发出耀眼的白光,因此常用来制造信号弹和焰火。下列元素与镁元素处于同一主族的是
A.Be
B.He
C.O
D.P
3、填空题 (14分)有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大。
①A元素最外层电子数是次外层电子数的2倍。
②B的阴离子和C的阳离子与氖原子的电子层结构相同。
③在通常状况下,B的单质是气体,0.1molB的气体与足量的氢气完全反应共有0.4mol电子转移。
④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质。
⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应。
请写出:
(1)A元素的最高价氧化物的电子式 ? 。
(2)B元素在周期表中的位置 ? 。
(3)B单质与C单质在点燃时反应的生成物中所含化学键类型有??。
(4)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为______________。
(5)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程的?。
(6)元素D与元素E相比,非金属性较强的是?(用元素符号表示),下列表述中能证明这一事实的是?(填选项序号)。
a.常温下D的单质和E的单质状态不同
b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应
d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质
4、选择题 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示
意图为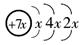 ,b与c形成的化合物的电子式为
,b与c形成的化合物的电子式为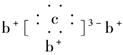 。下列说法中正确的是( )
。下列说法中正确的是( )
A.原子半径:b>d>a>c
B.电负性:a>b>d>c
C.原子序数:d>a>c>b
D.最高价含氧酸的酸性:c>d>a
5、选择题 下列关于科学家及其创立原子结构模型的叙述错误的是(?)
A.19世纪初,英国科学家道尔顿提出原子学说
B.1911年,卢瑟福根据α粒子散射现象,提出了带核的原子结构模型
C.汤姆生发现原子中存在电子,并提出原子结构轨道模型
D.20世纪初,科学家指出必须用量子力学方法描述核外电子的运动