时间:2025-06-25 21:38:32
1、选择题
L-1 CH3COOH水溶液,⑤50 mL 0.20 mol·L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
A.①>②>③>④>⑤
B.②>①>③>④>⑤
C.②>③>④>①>⑤
D.⑤>④>③>②>①
2、选择题 25℃时在五份蒸馏水中分别加入适量的下列物质,所得实验结果如下表所示:
| 加入物质 | HCl(aq) | FeCl3 | NaOH | HCOONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
3、填空题 (4分)设水的电离平衡曲线如图所示: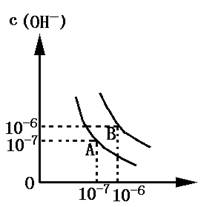
⑴若以A点表示水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从?增加到?.
⑵将pH=8的Ba(OH)2溶液与PH=5的稀盐酸相混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2与盐酸的体积比为?
4、选择题 常温下,向100 mL 0.1 mol·L-1 H2A(二元酸)溶液中逐滴加入0.2 mol·L-1 NaOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列有关说法正确的是( )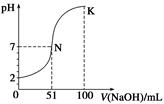
A.H2A为二元强酸
B.N点对应溶液有:c(Na+)=c(A2-)+c(HA-)
C.K点对应溶液中离子浓度由大到小的顺序为c(A2-)>c(Na+)>c(OH-)>c(H+)
D.K点时加水稀释溶液,c(H+)增大
5、填空题 实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定至完全反应。
(1)碳酸钠溶液呈明显的碱性,主要原因是(用离子方程式表示)?。
当用热水溶解时碱性更强是因为?。
(2)由于CO2溶在溶液中会影响pH值,为准确滴定,终点宜选在pH值4—5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用?。终点颜色变化是?。
(3)若达到滴定终点时,中和W克Na2CO3消耗盐酸V毫升,则盐酸的物质的量的浓度为? mol/L。
(4)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为C1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为C2 mol/L。在下述情况下,C1与C2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则C1?C2
②当Na2CO3中含有NaOH时,则C1?C2