时间:2025-06-25 21:37:44
1、填空题 某校高一研究性学习小组将造成某市空气污染的主要原因分为以下四种:
A.燃烧农作物秸秆 B.燃烧含硫煤 C.粉尘污染 D.机动车尾气污染
并就造成该市空气污染的最主要原因调查了该市100名市民和100位环保部门人士。调查结果如下图所示: 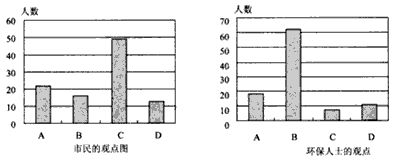
(1)凋查结果显示:该市市民认为造成空气污染的最主要原因是______________,环保人士认为造成该市空气污染的最主要原因是_____________。
(2)调查结果说明市民对造成空气污染的最主要原因认识不足。该最主要原因造成的大气污染的主要有害成分是____________。当空气中该成分含量较高时,在空气中的氧气和水的共同作用下,会形成酸雾,其化学反应方程式为____________________。
(3)下列措施中能够减少该成分排放量的是____________。
①用天然气代替煤炭做民用燃料
②植树造林
③工厂生产时将燃煤锅炉的烟囱造得更高
④燃煤中加入适量石灰石后使用
⑤在已经酸化的土壤中加生石灰
⑥使用电动车
参考答案:(1)C;B
(2)SO2;2SO2+O2+2H2O=2H2SO4
(3)①④⑥
本题解析:
本题难度:一般
2、选择题 下列说法中错误的是( )
A.保护环境就是保护人类自身
B.环境污染主要包括大气污染、水污染、土壤污染、食品污染等
C.人吸入二氧化硫,会发生呼吸道疾病
D.消除大气污染的根本方法是限制化学工业的发展
参考答案:D
本题解析:科学发展会促进社会的进步,有时会造成环境污染,给人类的生活带来危害,影响身心健康,清除大气污染的根本方法应是控制污染源的排放。
本题难度:简单
3、填空题 (14分) 为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下: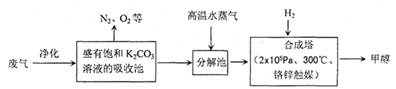
(1)合成塔中反应的化学方程式为?;△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了?。
(2)从合成塔分离出甲醇的原理与下列??操作的原理比较相符(填字母)
A.过滤? B.分液? C.蒸馏? D.结晶
工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括?。
(3)一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是?。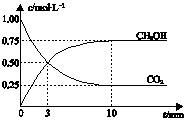
A.升高温度能使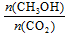 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1
(4) 如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知?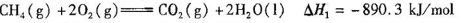

写出C02(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式
___________? _____。
参考答案:(14分)(1)CO2+3H2=CH3OH+H2O(3分)?催化剂的催化活性(2分)?
(2)C(2分)?高温水蒸气或反应热(2分)?(3)B(3分)
(4) CO2(g)+4H2 (g) = CH4(g)+2H2O(l) ΔH=-252.9kJ/mol (3分)
本题解析:1)根据工艺流程可知,合成塔内反应是氢气与二氧化碳反应生成甲醇和水;
工业生产条件选择要考虑转化率、反应速率、对催化剂的影响、材料、成本等多方面综合考虑;
(2)从合成塔出来的主要为甲醇与水的混合液,甲醇与水互溶,沸点相差大;
(3)由流程图可以找出循环利用的物质;
(4)由图可知,10min达平衡,根据v=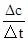 计算v(CH3OH)反应速率之比等于化学计量数之比计算氢气的反应速率;
计算v(CH3OH)反应速率之比等于化学计量数之比计算氢气的反应速率;
平衡向正反应移动,可以增大n(CH3OH)/n(CO2)的值;
(5)根据盖斯定律构造目标热化学方程式.
解:
(1)合成塔中的反应是二氧化碳和氢气在一定条件下可生成甲醇和水,其方程式为:
CO2+3H2一定条件CH3OH+H2O;
温度影响催化剂的活性,除考虑温度对反应速率的影响外,还主要考虑了催化剂的催化活性,
故答案为:CO2+3H2 = CH3OH+H2O;主要考虑了催化剂的催化活性;
(2)分离沸点相差比较大,互溶的液体,可以用蒸馏的方法进行分离,故选:C;
(3)(3)由工艺流程可知,可重复利用的物质有K2CO3溶液和CO2、H2、高温水蒸气,故答案为:高温水蒸气;
(4)(4)由图可知,10min达平衡,平衡时甲醇的浓度为0.8mol/L,
(5)所以v(CH3OH)=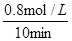 =0.08mol/(L?min),反应速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.08mol/(L?min)=0.24mol/(L?min).
=0.08mol/(L?min),反应速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.08mol/(L?min)=0.24mol/(L?min).
(6)增大H2的用量、减少生成H2O 的量等,平衡右移,可以增大n(CH3OH)/n(CO2)的值,
(7)故答案为:0.24mol/(L?min);增大H2的用量等;
(8)(5)巳知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol,
②H2(g)+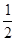 O2(g)=H2O(l)△H2=-285.8kJ/mol,
O2(g)=H2O(l)△H2=-285.8kJ/mol,
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式可
根据盖斯定律②×4-①得CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol?。
本题难度:一般
4、填空题 空气质量越来越受到人们的关注,下表是我国部分城市空气质量周报(注:TSP--总悬浮颗粒物;NOx--氮氧化物)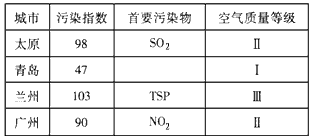
(1)由上表可知,从理论上分析最容易出现酸雨的城市是____。
(2)悬浮颗粒物不易沉降,它与空气中的SO2、O2接触时,SO2会部分转化为SO3,悬浮颗粒物所起的作用是____ (填序号)。
A.氧化剂 B.还原剂 C.催化剂 D.吸附剂
(3)氮的氧化物也是大气污染物之一。目前,治理NO的方法是在一定条件下用氨把一氧化氮还原为氮气和水。科学家又设想,在相同条件下可采用价格比NH3更便宜的天然气来处理NO,达到同样效果,写出该反应的化学方程式____。
参考答案:(1)太原
(2)C
(3) 4NO+CH4 =2N2+ CO2+2H2O
本题解析:
本题难度:一般
5、选择题 石头纸(Rich Mineral Paper,RMP)也叫石科纸,就是用磨成粉末的石头为主要原料,加上15%的聚乙烯和5%胶合剂做成的。2010年两会期间,政协委员们领到的会议通知、日程表、便签纸等都是以碳酸钙为主要原料的低碳“石头纸”。下列有关“石头纸”的说法错误的是
[? ]
A.“石头纸”不宜在高温条件下生产
B.“石头纸”与普通纸张比较,不易燃烧
C.“石头纸”能耐强酸与强碱的腐蚀
D.推广使用“石头纸”能达到保护森林和环保的目的
参考答案:C
本题解析:
本题难度:简单