时间:2025-06-25 21:36:55
1、简答题 A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
(1)B在周期表中的位置第______周期,第______族;
(2)E元素形成的氧化物对应的水化物的化学式为______;
(3)元素C、D、E形成的离子半径大小关系是______>______>______(用离子符号表示).
(4)用电子式表示化合物D2C的形成过程______.C、D还可形成化合物D2C2,D2C2含有的化学键是______.
(5)由A、B、C三种元素形成的离子化合物的化学式为______,它与强碱溶液反应的离子方程式是______.
(6)某一反应体系中含有D2E、D2EC3、D2EC4三种物质,若此反应为分解反应,则此反应的化学方程式为(化学式用具体的元素符号表示):______.
2、填空题 开发新型储氢材料是氢能利用的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4—构成,BH4—呈正四面体构型。LiBH4中不存在的作用力有______(填标号)。
A.离子键?B.共价键?C.金属键?D.配位键
③Li、B、H元素的电负性由大到小排列顺序为______。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+______H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是______(填元素符号)。
(3)某种新型储氢材料的理论结构模型如下图所示,图中虚线框内碳原子的杂化轨道类型有______种。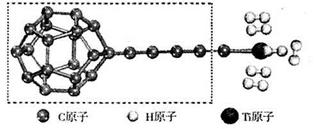
(4)分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是______(填标号)。
A.H2O?B.CH4?C.HF ?D.CO(NH2)2
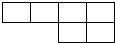
3、填空题 原子序数递增的部分短周期主族元素的原子半径数据如下表:
| 元素 | A | B | D | E | F | G | M | N | P |
| 原子半径/nm | 0.077 | 0.070 | 0.066 | 0.064 | 0.186 | 0.160 | 0.143 | 0.104 | 0.099 |
4、选择题 下列物质中,既含有离子键又含有共价键的是?
[? ]
A.CO2
B.Na2O
C.NH4Cl
D.CaCl2
5、选择题 对比下列几个式子:Cl+Cl→Cl2(放热247kJ),O+O→O2(放热493kJ)以及N+N→N2(放热946kJ)可以得出结论是( )
A.在常温下氮气比氧气和氯气稳定
B.氯气、氮气、氧气常温下为气体
C.在常温下氯气比氮气和氧气稳定
D.氯气、氮气、氧气的密度不同