时间:2025-06-25 21:15:41
1、选择题 下列关系式不正确的是
[? ]
A.常温下pH=2的甲酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(HCOO-)> c(OH-) >c(H+)
B.0.1mol·L-1Na3PO4溶液中:c(OH-)=c(H+)+c(HPO42-)+2c(H2PO4-)+3c(H3PO4)
C.0.4mol·L-1Ba(OH)2溶液与0.3mol·L-1NaHCO3溶液等体积混合:
c(OH-)>c(Na+)>c(Ba2+)>c(CO32-)
D.1L0.3mol·L-1NaOH溶液吸收标准状态下4.48LCO2:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
参考答案:D
本题解析:
本题难度:一般
2、选择题 在25?mL?0.1?mol·L-1?NaOH溶液中逐滴加入0.2?mol·L-1 CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是? 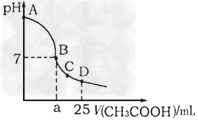
[? ]
A.对于曲线上AB间任一点,溶液中都有: c(Na+)?>c(CH3COO-)?>c(OH-)?>c(H+)
B.在B点,a>12.5,且有 c(Na+)?=?c(CH3COO-)?=?c(OH-)?=?c(H+)
C.在C点,c(CH3COO-)?-?c(Na+)?=?c(H+)?-?c(OH-)
D.在D点,c(CH3COO-)?+?c(CH3COOH)?=?c(Na+)
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列溶液中微粒浓度关系一定正确的是
[? ]
A.氨水与氯化铵的pH=7的混合溶液中:[Cl-]>[NH4+]
B.pH=2的一元弱酸和pH=12的一元强碱等体积混合,因生成的盐水解使溶液中c(OH-)> c(H+)
C.0.1 mol·L-1的硫酸铵溶液中:c(NH4+)> c(SO42-)> c(H+)
D.0.1 mol·L-1的硫化钠溶液中:c(OH-)= c(H+)+ c(HS-)+ c(H2S)
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
[? ]
A.0.1mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1mol/L NH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
参考答案:A
本题解析:
本题难度:一般
5、选择题 从下列事实所列出的相应结论正确的是
[? ]
A.Cl2的水溶液可以导电---Cl2是电解质
B.SO2通入硝酸钡溶液出现白色沉淀---BaSO3不溶于强酸
C.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀---结合H+的能力:CO32-< AlO2-
D.常温下白磷可自燃而氮气须在放电时才与氧气反应---非金属性:P>N
参考答案:C
本题解析:
本题难度:简单