时间:2025-06-25 21:09:50
1、填空题 汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源,必须予以治理。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使汽油、柴油等物质充分燃烧及SO2的转化。
(1)汽车尾气中NO的来源是________。?
A.汽油、柴油中含氮,是其燃烧产物?
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物?
D.是汽车高温尾气导致了空气中N2与O2的化合反应?
(2)写出CO与NO反应的化学方程式:______________。?
(3)“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是_____________?。
(4)控制或者减少城市汽车尾气污染的方法可以有_____________。(多选)
A.开发氢能源 B.使用电动车 C.限制车辆行驶? D.使用乙醇汽油
参考答案:(1)C?;
(2)2CO+2NO 2CO2+N2?;?
2CO2+N2?;?
(3)SO2转化为SO3,产生了硫酸酸雾?;?
(4)ABD
本题解析:
本题难度:一般
2、填空题 近来研究认为松果体分泌物——“退黑素”(简称MLT)与人的寿命长短有关,有人把“退黑.素”和克隆技术并称为“20世纪生命科学的两大发现”。“退黑素”的化学结构简式为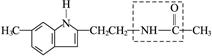
(1)“退黑素”的分子式为________________________________________________________。
(2)“退黑素”结构简式中,虚线框内的结构名称为__________________________________,它在稀硫酸中受热后生成的具有酸性的物质为____________________________。
参考答案:(1)C13H16N2O? (2)肽键? CH3COOH(乙酸)
本题解析:注意分析多肽的结构。
本题难度:简单
3、选择题 化学已经渗透到人类生活的各个方面,下列说法不正确的是。
[? ]
A.?高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能消毒杀菌又能净水。
B.?“光化学烟雾”、“臭氧空洞”、“硝酸酸雨”的形成都与氮氧化合物有关 ?
C.?低碳生活注重节能减排,尽量使用太阳能等代替化石燃料,减少温室气体的排放
D.?高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”。
参考答案:D
本题解析:
本题难度:简单
4、选择题 绿色化学是从源头上防止污染产生或将化学过程对环境的负面影响降低到最低限度的化学。不仅化工生产应遵循绿色化学的原则,化学实验也应遵循绿色化学的原则,实现原料和过程的绿色化。 “绿色化学”是预防污染的基本手段,下列做法属于“绿色化学”的是
A.处理废弃物
B.杜绝污染源
C.禁食有毒物
D.制订治污规章制度
参考答案:B
本题解析:A、处理废弃物是污染治理措施,污染已经产生,不是从源头消除污染,不符合绿色化学理念,所以错误;B、杜绝污染源是从源头消除污染,符合绿色化学理念,所以正确;C、禁食有毒物,也不是从源头消除污染,不符合绿色化学理念,所以错误;D、制订治污规章制度,也不是从源头消除污染,不符合绿色化学理念,所以错误,答案选B。
点评:环保问题已经引起了全球的重视,是高考中的热点问题,化学上提倡绿色化学工艺,要求从源头上杜绝污染,有利于培养学生的环境保护意识和能源节约意识。
本题难度:简单
5、选择题 (I)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于?。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a. 6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2 CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH
CH3COOH
d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
以上反应中,最节能的是?,原子利用率最高的是?。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=? ?。
②该反应的平衡常数表达式为?,升高温度,平衡常数的数值将
?(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是?.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1molCO2和3molH2
(II)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)  ?2NH3(g)?△H=-93.4kJ/mol
?2NH3(g)?△H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。

图t1时引起平衡移动的条件可能是?。
其中表示平衡混合物中NH3含量最高的一段时间是?。
②温度为T°C时,将3amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的体积分数为?。
参考答案:(I)(1)保护臭氧层
(2)a,c。
(3)①0.225
解析:①从反应开始到平衡,氢气的平均反应速率v(H2)=3v(CH3OH)=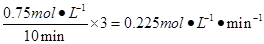
②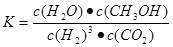 ,减小
,减小
③CD
(II)①加压,t2~t3?②75%
本题解析:
(I)(1)保护臭氧层
由于氟利昂化学性质稳定,具有不燃、低毒、介电常数低、临界温度高、易液化等特性,因而广泛用作冷冻设备和空气调节装置的制冷剂。由于氟利昂可能破坏大气臭氧层,已限制使用。臭氧层被大量损耗后,吸收紫外线辐射的能力大大减弱,导致到达地球表面的紫外线明显增加,给人类健康和生态环境带来多方面的危害。
(2)a,c。
a最节能,利用光合作用,将光能转化为化学能;C,是化合反应,原子利用率100%。
(3)①0.225
②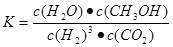 ,减小
,减小
解析:②该反应的平衡常数表达式为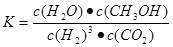 ,该反应为放热反应,升高温度,平衡逆向移动,平衡常数的数值将减小(填“增大”、“减小”或“不变”)。
,该反应为放热反应,升高温度,平衡逆向移动,平衡常数的数值将减小(填“增大”、“减小”或“不变”)。
③CD
解析:③下列措施中能使n(CH3OH)/n(CO2)增大的是?.
A.升高温度,平衡逆向移动,n(CH3OH)/n(CO2)减小
B.充入He(g),使体系压强增大,但体积不变,平衡不移动,n(CH3OH)/n(CO2)不变。
C.将H2O(g)从体系中分离,平衡正向移动,n(CH3OH)/n(CO2)增大
D.再充入1molCO2和3molH2,相当于加压,平衡正向移动,n(CH3OH)/n(CO2)增大。
(II)①加压,t2~t3?②75%
解析:①从图看出正、逆反应速率均增大,正反应速率变化大于逆反应速率,平衡正向移动,加压符合。
其中表示平衡混合物中NH3含量最高的一段时间是t2~t3,t3~t4时平衡逆向移动,NH3含量变小,t4~t5平衡不移动,NH3含量与前一段时间相同。
②可逆反应:? N2?+? 3H2? =? 2NH3
起始:? a? 3a
平衡:? a-0.5a? 3a-1.5a?a
起始2:? a? 3a? 2a
折算相当于:2a? 6a?0
平衡:? 2a-1a? 6a-3a?2a
由于是容积可变的反应容器,反应物物质的量为原来的2倍,混合气的体积也就为原来的2倍(原题应该说是恒压下比较好),浓度与原来相等,达到等效平衡。
混合气中H2的体积分数与原平衡相等,即(3a-1.5a)÷(a-0.5a+3a-1.5a+1a)×100%=50%。
(原答案有误)
本题难度:一般