时间:2025-06-25 21:07:30
1、填空题 (8分)防止水体污染,改善水质,最根本的措施是控制工业废水和生活污水的排放。有一种工业废水,已知其中含有大量的Fe2+和SO42-,少量的Ag+ 以及部分污泥。某校化学兴趣小组同学通过下列操作过程,回收物质,处理废水。
根据上述操作过程,回答下列问题:
参考答案:(8分)(1)漏斗烧杯玻璃棒?(2)蒸发结晶
(3)Fe? Fe+2Ag+=Fe2++2Ag?(4)银和硫酸亚铁晶体
本题解析:(1)操作①是过滤,需要的主要玻璃仪器有漏斗、烧杯、玻璃棒。
(2)溶质从溶液中析出,需要蒸发结晶。
(3)要回收单质银,且不能在引入杂质,则X应该是铁,发生反应的离子方程式是Fe+2Ag+=Fe2++2Ag。
(4)根据转化图可知,固体B是银,晶体是硫酸亚铁晶体
点评:把物质中混有的杂质除去而获得纯净物叫提纯,将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
2、填空题 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)变化曲线如图。
(1)加MgO后过滤所得滤渣的主要成分为?。
(2)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全??。
(3)加入NaClO3饱和溶液会发生如下反应:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应,②?;③?;④?;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(4)上述产品测定中需要检查是否漏液的仪器有?。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏?。(填“大”或“小”)。
(5)产品中Mg(ClO3)2·6H2O的质量分数为?。(计算结果保留两位小数)
参考答案:(1)BaSO4和Fe(OH)3?
(2)静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全(现象+判断1分)
(3)①蒸发结晶?②趁热过滤?③ 冷却结晶?
(4)容量瓶?滴定管?偏小
(5)78.31%
本题解析:(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,故答案为:漏斗、玻璃棒、烧杯;BaSO4和Fe(OH)3;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42﹣沉淀完全,故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42﹣沉淀完全;
(3)根据物质的溶解度大小,溶液获得晶体的方法:蒸发结晶;趁热过滤;冷却结晶;
(4)上述产品测定中需要检查是否漏液的仪器有容量瓶和滴定管 。步骤3中若滴定前不用标准液润洗滴定管,相当于把标准液稀释了,消耗的标准液的体积就会偏高,会导致最终结果偏小。
(5)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O;②根据化学方程式:ClO3﹣+6Fe2++6H+=6Fe3++Cl﹣+3H2O以及Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3﹣~6Fe2+,Cr2O72﹣~6Fe2+,用0.100mol?L﹣1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol?L﹣1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10﹣3L×1.000mol?L﹣1﹣0.009mol=0.011mol,氯酸根离子的物质的量为: ×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:(
×0.011mol,产品中Mg(ClO3)2?6H2O的质量分数:( ×0.011×299g/mol)×10×
×0.011×299g/mol)×10× ×100%=78.3%.故答案为:78.3%。
×100%=78.3%.故答案为:78.3%。
本题难度:一般
3、选择题 配制0.1mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏低的是
A.称量时,右盘高,左盘低?
B.定容时俯视读取刻度?
C.原容量瓶洗净后未干燥?
D.定容时液面超过了刻度线?
参考答案:D
本题解析:分析:A、用托盘天平称量药品时天平左盘放药品,右盘放砝码;
B、定容时俯视读取刻度,溶液的实际体积偏小;?
C、原容量瓶洗净后未干燥对实验结果无影响;
D、定容时液面超过了刻度线,溶液体积偏大;
解答:根据c=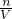 和m=n×M进行判断:
和m=n×M进行判断:
A、用托盘天平称量药品时天平左盘放药品,右盘放砝码,称量时,右盘高,左盘低,药品实际质量偏大,n偏大,则c偏大,故A不选;
B、定容时俯视读取刻度,溶液的实际体积偏小,c偏大,故B不选;
C、原容量瓶洗净后未干燥对实验结果无影响,故C不选;
D、定容时液面超过了刻度线,溶液体积偏大,c偏小,故D选.
故选D.
点评:本题考查配制一定物质的量浓度溶液的方法,本题难度不大,做题时从c=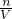 的角度分析不当操作对溶液浓度的影响.
的角度分析不当操作对溶液浓度的影响.
本题难度:简单
4、选择题 下列除杂质的方法不可行的是
[? ]
参考答案:A
本题解析:
本题难度:一般
5、选择题 为除去括号内的杂质,所选用的试剂或方法不正确的是
[? ]
A.Na2CO3溶液(NaHCO3),选用适量NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在空气中加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
参考答案:D
本题解析:
本题难度:一般