时间:2021-06-11 07:16:34
1、选择题 判断过程的自发性的作用是
A.判断过程的方向
B.确定过程是否一定会发生
C.判断过程发生的速率
D.判断过程的热效应
参考答案:A
本题解析:在一定温度压强下,熵变和焓变共同决定反应的自发性,判断过程的自发性的本质是判断过程的方向,与反应速率、热效应、是否发生无关,选A。
点评:考查基础知识,难度不大,但易错。
本题难度:简单
2、选择题 下列反应不属于可逆反应的是( )
A.2Na+2H2O═2NaOH+H2↑
B.SO2+H2O?H2SO3
C.NH3?H2O?NH3+H2O
D.N2+3H2?
参考答案:A、钠与水剧烈反应生成氢氧化钠和氢气,反应不是可逆反应,故A符合;
B、二氧化硫和水反应生成的亚硫酸是弱酸存在电离平衡,所以反应是可逆反应,故B不符合;
C、一水合氨是弱碱水溶液中存在电离平衡,是可逆反应,故C不符合;
D、氮气和氢气合成氨同时氨气分解为氮气和氢气,故反应是可逆反应,故D不符合;
故选A.
本题解析:
本题难度:一般
3、选择题 下列关于自发过程的叙述中,正确的是
[? ]
A.只有不需要任何条件就能够自动进行的过程才是自发过程
B.需要加热才能够进行的过程肯定不是自发过程
C.同一可逆反应的正逆反应在不同条件下都有自发的可能
D.非自发过程在任何条件下都不可能变为自发过程
参考答案:C
本题解析:
本题难度:简单
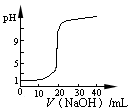
4、选择题 下列图示与对应的叙述相符的是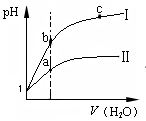 ?
? ?
?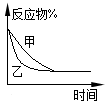 ?
?
图1?图2?图3?图4
A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2表示0.1000 mol·L-1CH3COOH溶液滴定20.00mL0.1000 mol·L-1NaOH溶液所得到的滴定曲线
C.图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
参考答案:D
本题解析:A项根据弱电解质稀释后浓度变化较小的原理,其中曲线I为盐酸,且b点溶液的导电性比a点弱;B项图2应该表示的是0.1000 mol·L-1NaOH溶液滴定pH=1的CH3COOH溶液所得到的滴定曲线;C项图3乙比甲的反应速率快,但是平衡没有移动,说明表示催化剂对平衡的影响;D项正确
点评:对于图像问题,一定要先观察图像的拐点、起点,横坐标与纵坐标,然后再分析题意。
本题难度:简单
5、计算题 在容积为2.0 L的密闭容器中充入0.60 mol X和1.60 mol Y,发生反应:
aX(g)+3Y(g)  ?2Z(g)
?2Z(g)
经过10 min反应达到平衡状态,Y的浓度为0.2 mol/L,Z的物质的量分数为 。
。
计算:① 10min内,Z的平均反应速率;
② a 的值;
③ 该条件下X的平衡转化率(百分数表示,保留一位小数);
④该条件下反应2Z(g)  ?aX(g)+3Y(g)的平衡常数。
?aX(g)+3Y(g)的平衡常数。
参考答案:①0.04mol/(L·min)? ②a=1? ③66.7%?④0.005
本题解析:考查可逆反应的有关计算,一般采用三段式。
aX(g)? +? 3Y(g)? ?2Z(g)
?2Z(g)
起始量(mol)? 0.6? 1.6? 0
转化率(mol)? 0.4a?1.2? 0.8
平衡量(mol)? 0.6-0.4a? 0.4? 0.8
所以有(0.6-0.4a+0.4+0.8)×4/7=0.8
解得a=1
Z的反应速率是
X的转化率是0.4÷0.6×100%=66.7%
平衡时XYZ的浓度分别是0.1mol/L、0.2mol/L、0.4mol/L
所以平衡常数等于
因此其逆反应的平衡常数就是0.005
本题难度:一般