时间:2021-06-11 07:16:12
1、实验题 (1)中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次。请你评价若用上述方法制取乙醛存在哪些不足
____________________________(写出两点)
某课外活动小组利用如图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去,粗黑线表示乳胶管。填写下列空白?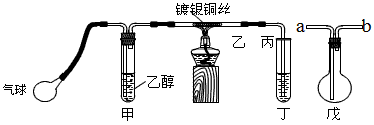
(2)甲装置常常浸在70~80℃ 的水浴中,目的是________________________。
(3)实验时,先加热玻璃管乙中的镀银铜丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为____________________________。
(4)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):乙接___________、___________接丙。
参考答案:(1)操作麻烦、乙醇转化率低(其它合理答案均可)
(2)使生成乙醇蒸气的速率加快
(3)放热;2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
(4)b;a
本题解析:
本题难度:困难
2、实验题 .利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
(A)?(B)?(C)?
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
①?、②?、③?、④?、⑤?、⑥?、⑦?.
(2)实验中使用了空气,其作用是?;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量?(填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是?,若缺乏干燥管Ⅱ,其后果是?.
(4)若分液漏斗中④的滴液速度过快,将导致实验结果?(填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为?。
参考答案:(1)① g?② f?③? d?④b ?⑤? a ?⑥? e ?⑦? e
(2) 使反应产生的CO2气体充分排出;偏低
(3)防止空气中的CO2和H2O被吸入干燥管Ⅰ中。使测出的样品中Na2CO3的质量分数偏大
(4) 偏低? (5)  ×100%.
×100%.
本题解析:(1)根据装置图可知,实验原理是利用碳酸钠和酸生成CO2,如果吸收CO2来计算碳酸钠的质量,由于生成的CO2中含有水蒸气,所以在通入碱石灰之前,还需要首先除去水蒸气。又因为装置中会残留CO2,所以还必需通入空气排尽装置的CO2。但其中也含有CO2,所以通入的可知首先要除去CO2,且还必需防止空气中的水蒸气和CO2被碱石灰吸收,所以正确顺序是① g?② f?③? d?④b ?⑤? a ?⑥? e ?⑦? e 。
(2)根据以上分析可知,使用空气的目的是使反应产生的CO2气体充分排出;;若通入空气的速度过快或通入空气的量不足,则生成的CO2不能完全气被吸收,因此结果偏低。
(3)由于空气中也含有水蒸气和CO2,所以干燥管Ⅱ的作用是防止空气中的CO2和H2O被吸入干燥管Ⅰ中;如果没有该装置,则吸收的CO2增加,碳酸钠的质量分数会偏大。
(4)若分液漏斗中④的滴液速度过快,则碳酸钠反应不完全,生成的CO2减少,测定结果偏低。
(5)干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则生成的CO2质量是(m2-m1)g,所以碳酸钠的质量就是(m2-m1)÷44×106,因此质量分数是 ×100%.。
×100%.。
本题难度:一般
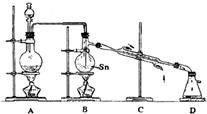
3、简答题 SnCl4的制备需分两步进行,第一步是金属Sn的制备,第二步由Sn和Cl2反应生成SnCl4.
第一步:金属Sn的制备--以锡石SnO2为原料,用足量的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为:______,粗锡经电解精炼可得纯锡,精炼时的阴极反应式为______.
第二步:SnCl4的制备--用干燥、纯净的Cl2与熔融的Sn反应制SnCl4,同时放出大量的热.已知SnCl4常温下是无色液体,沸点114℃,遇潮湿空气便发生水解反应,Sn的熔点:231℃,右图是制取SnCl4的实验装置.
试回答以下问题:
(1)装置A中反应的化学方程式为______;
(2)当反应生成SnCl4时,应熄灭______处的酒精灯,理由是______;
(3)装置B的主要缺点是______,装置D的主要缺点是______;
(4)即使装置B和装置D进行改进后,老师说该实验装置设计仍不完整,请你协助该研究小组设计出所缺装置(须标出试剂的名称)并在下边方框中画出.
参考答案:利用质量守恒定律和写出化学方程式,应为SnO2+2C?高温?.?Sn+2CO;电解精炼可得纯锡,精炼时的阴极发生还原反应生成Sn,电解精炼可得纯锡,精炼时的阴极?Sn2++2e-=Sn.故答案为:SnO2+2C?高温?.?Sn+2CO;Sn2++2e-=Sn;
(1)A为实验室制备氯气的反应,化学方程式为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2;
(2)该反应放热,停止加热B装置,可依靠反应放出的热量维持Sn的熔化;故答案为:B;依靠反应放出的热量维持Sn的熔化;
(3)反应需控制在一定温度范围之内,需要温度计;根据题意知SnCl4遇潮湿空气便发生水解反应,生成物应干燥,在装置D后应连接一个装有碱石灰的干燥管可达到目的,故答案为:缺少温度计;装置D后应连接一个装有碱石灰的干燥管;
(4)A制得的氯气没有除杂和干燥,会导致SnCl4水解,不利于SnCl4制备,则在A、B之间加除杂和干燥装置,故答案为: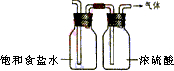
.
本题解析:
本题难度:一般
4、实验题 (6分)为了验证浓H2SO4和木炭在加热时发生反应生成的各种产物,甲、乙两学生分别设计如下实验方案:(图中→表示气体流向)
(1)上述方案可达到实验目的的是______________(填“甲”或“乙”)。
(2)具体说明能达到实验目的的方案中,气体通过的各装置(用字母表示)的作用:?。
参考答案:(1)乙?(2)A.验证反应生成的水? B.验证产生的SO2? C.除SO2气体? D.检验SO2是否除尽? e.验证产生的CO2
本题解析:略
本题难度:简单
5、实验题 (1)浓硫酸与木炭粉在加热条件下的化学方程式为___________________。
(2)已知KMnO4酸性溶液可以吸收SO2,试用下图中各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是(填装置的编号): __________→___________→_________→________。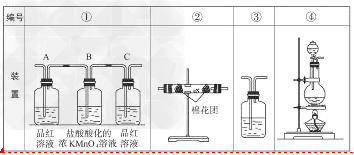
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______________,B瓶溶液的作用是__________,C瓶溶液的作用是______________。
(4)装置②中所加的固体药品是________,可确证的产物是,确定装置②在整套装置中位置的理由是________________________。
(5)装置③中所盛溶液是_______________,可验证的产物是_____________。?
参考答案:(1)C+2H2SO4(浓) ?2SO2↑+CO2↑+2H2O↑
?2SO2↑+CO2↑+2H2O↑
(2)④?②?①?③
(3)验证产物气流中是否有SO2?;将SO2全部氧化吸收?;确证产物中SO2已被B瓶溶液全部氧化
(4)无水CuSO4(或变色硅胶),?水蒸气?;?由于产物气流通过①③时会带出水蒸气,所以②必须在①③之前
(5)澄清石灰水?;CO2
本题解析:
本题难度:一般