时间:2021-06-11 07:15:49
1、选择题 0.1?L?1?mol/L?FeCl3溶液与0.2?L?1?mol/L?KCl溶液中的Cl一的数目之比为
A.3∶1
B.1∶2
C.3∶2
D.1∶3
参考答案:C
本题解析:
本题难度:简单
2、选择题 在铝和NaOH溶液的反应中,作为氧化剂的是( )
A.水
B.铝
C.氢氧化钠
D.氢氧化钠和水
参考答案:A
本题解析:在铝和NaOH溶液的反应中,铝先和水反应,生成氢氧化铝和氢气,水做氧化剂,铝做还原剂,然后生成的氢氧化铝在和氢氧化钠反应生成偏铝酸钠和水,是非氧化还原反应,故铝和NaOH溶液反应氧化剂是水,选A 。
本题难度:一般
3、填空题 (6分)(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+ 转变为易吸收的Fe2+,,这说明维生素C具有 [(填“氧化性”或“还原性”)
(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时的反应为:S+2KNO3 +3C=K2S+N2↑+3CO2↑.该反应中还原剂是 ,氧化剂是 。
+3C=K2S+N2↑+3CO2↑.该反应中还原剂是 ,氧化剂是 。
参考答案: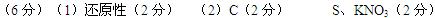
本题解析:略
本题难度:一般
4、选择题 下列减压过滤装置示意图正确的是
A.
B.
C.
D.
参考答案:C
本题解析:分析:减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀,所用玻璃仪器为吸滤瓶、安全瓶、抽气泵.
解答:根据减压过滤装置特点:布氏漏斗颈的斜口要远离且面向吸滤瓶的抽气嘴,并且安全瓶中的导气管是短进长出,优点:可加快过滤速度,并能得到较干燥的沉淀,以及含有的玻璃仪器:吸滤瓶、安全瓶、抽气泵可以确定装置为C.
故选C.
点评:本题考查学生常见的化学仪器,要求学生熟悉常见仪器,并掌握其应用,难度不大.
本题难度:简单
5、选择题 下列物质中,属于天然高分子化合物的是
A.脂肪
B.纤维素
C.氨基酸
D.蔗糖
参考答案:B
本题解析:本题考查有关天然高分子化合物的概念。A项具有一定的迷惑性,其式量大约为800左右,仍小于10 000,所以它不是高分子化合物。
本题难度:简单