时间:2021-06-11 07:10:33
1、计算题 将12.8克由CuSO4和Fe组成的固体,加入足量的水中充分反应后,滤出固体,干燥后称得5.2克。求原混合物中CuSO4和Fe各为多少克?
参考答案:CuSO4为8克,Fe为4.8克
本题解析:此题有三种反应可能:恰好完全反应、CuSO4过量、Fe过量。
余下固体有两可能:(1)余下Fe和Cu;(2)余下全是Cu.
(1)当余下固体是Fe和Cu(即Fe过量)时,设x克CuSO4耗尽,则铁为(12.8-x)克,置换差量为5.2-(12.8-x)克。
CuSO4 + Fe  ?FeSO4 +Cu?固体增重
?FeSO4 +Cu?固体增重
160? 56? 64? 64-56=8(理论差量)
x? 5.2-(12.8 -x)(实际差量)
-x)(实际差量)
160:x=8:[5.2-(12.8-x)]
∴? x=8(克),12.8-x=4.8(克)。
(2)设余下固体全是Cu,反应时有w克Fe耗尽。
CuSO4 + Fe  ?FeSO4+ Cu?固体增重
?FeSO4+ Cu?固体增重
56? 64? 64-56=8(理论差量)  ?W? 5.2-w(实际差量)
?W? 5.2-w(实际差量)
56:w=8:5.2-w
∴? w=4.55(克),
则原混合物中CuSO4为12.8-4.55=8.25(克)。
而8.25克CuSO4中只含8.25×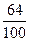 =3.3(克)Cu,故不可能有5.2克Cu生成。由此可见(2)的假设不成立。
=3.3(克)Cu,故不可能有5.2克Cu生成。由此可见(2)的假设不成立。
本题难度:简单
2、选择题 m g FeO、Fe2O3、CuO的混合物,加入120mL 1.0mol/L H2SO4溶液中完全溶解,向所得溶液中逐滴加入1.5mol/L NaOH溶液至刚出现沉淀时,消耗NaOH溶液40mL;将m g的混合物用CO气体加热还原,实验过程中耗去标准状况下的CO3.36升,得固体w g。则w的值为
A.m-0.96
B.m-1.44
C.m-1.6
D.m-2.4
参考答案:B
本题解析:向所得溶液中加入NaOH溶液,是为了中和体系中的硫酸,故体系中硫酸为0.03mol。所以生成金属硫酸盐的硫酸根离子为0.12-0.03=0.09mol。因原氧化物中氧原子数目与金属硫酸盐中硫酸根离子数目相等,故混合物中的氧原子也为0.09mol,质量为0.09*16=1.44克,所以混合物中金属的质量w=m-1.44。
故选B
本题难度:简单
3、实验题 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成:
①铁不同价态的物质各写一种(并标出铁元素的化合价):_____、_______、 ________。
②写出一个它们之间相互转化(含三种价态)的化学方程式:___________________ 。
(2)实验室提供的下列试剂:锌粒、铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性。
根据氧化还原反应的有关原理,小明说Fe2+既有还原性又有氧化性,为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe2+具有还原性 | 取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________ | 溶液变成血红色 |
| 探究Fe2+具有氧化性 | 取少量0.1 mol·L-1 FeCl2溶 液,加入_________充分 反应 | 溶液由浅绿色变无色 所发生反应离子方程式为________________ |
参考答案:(1)①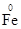
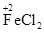
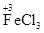 (其他合理的答案也可)②Fe+2FeCl3=3FeCl2
(其他合理的答案也可)②Fe+2FeCl3=3FeCl2
(2)
实验方案
实验现象
取少量0.1 mol·L-1 FeCl2溶液,加入足量新制氯水后,再往溶液中加入少量KSCN溶液
加入氯水后,溶液由浅绿色变黄色,再加入少量KSCN溶液后溶液变红色
取少量0.1 mol·L-1 FeCl2溶液,加入锌粒充分反应
加入锌粒后,溶液由浅绿色变无色Fe2++Zn=Fe+Zn2+
本题解析:(1)铁常见的化合价就只有三种:零价、正二价、正三价;金属铁还原三价铁离子成二价铁离子就是一个三种化合价的铁都有的铁的反应方程式;
(2)还原性的检验是用氯水来氧化二价铁离子,氧化性的检验是用多属单质来还原三价铁离子。
本题难度:一般
4、实验题 (15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白: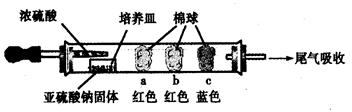
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | ? | 棉球变白,微热后又恢复红色 | ? |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:? |
| c | ? ? | 棉球变为白色 | 该气体具有??(选填“氧化性”或“还原性”) |
参考答案:Ⅰ
棉球
棉球上滴加的试剂
现象
解释和结论
a
品红试液
?
SO2具有漂白性,且为暂时性漂白
b
?
?
离子方程式:2OHˉ+ SO2 = SO32ˉ+ H2O 或OHˉ+SO2=HSO3ˉ?
c
含淀粉的碘水
?
? 还原??性
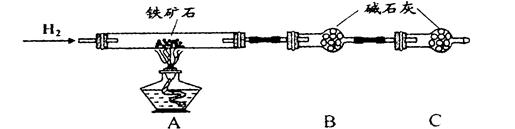
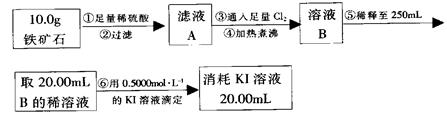
Ⅱ、实验一:(3)在C装置出口处收集H2并验纯后(2分)? (5)24%(2分)
实验二:(1))烧杯、玻璃棒(2分)(2)bc(2分)
实验结论: Fe5O6(2分)
本题解析:Ⅰ、a、品红试液是红色的,二氧化硫能使品红褪色,漂白原理是:SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红,又恢复红色;
b、氢氧化钠遇到酚酞也是红色的,二氧化硫能和氢氧化钠反应导致红色消失,反应原理是:SO2+OH-=HSO3-;
c、碘单质遇到淀粉变为蓝色,二氧化硫能将碘单质还原为碘离子,SO2+I2+2H2O=H2SO4+2HI,从而使蓝色消失;
Ⅱ、实验一:(1)(2)测的反应后装置B增重2.70g,根据反应的实质,增加的是氧元素的质量,所以氧元素的质量分数是: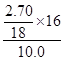 ×100%=24%,
×100%=24%,
故答案为:24%;
实验二:(2)a、滴定管用蒸馏水洗涤后必须用标准液润洗,故a错误;
b、锥形瓶不需要用待测液润洗,故b错误;
c、碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,故c正确;
由实验一,n(H2O)=2.7g/18g/mol=0.15mol
H2?~ H2O ?~?O
0.15mol? 0.15mol
由实验二, 2Fe3++2I- 2Fe2++I2?Fe3+?~? I-
2Fe2++I2?Fe3+?~? I-
?0.5×0.02? 0.5×0.02
n(Fe3+)=0.5mol/L×0.25L=0.125mol?
Fe3+?~?Fe
0.125mol? 0.125mol
所以n(Fe):n(O)=0.125mol:0.15mol=5:6
本题难度:困难
5、计算题 (6分) 铁粉和氧化亚铁粉末的混合物共9.2克,加入到150mL的稀硫酸中,恰好完全反应,得到氢气2.24L(标准状况)。求:
(1)混合物中铁和氧化亚铁的质量?
(2)原稀硫酸的物质的量浓度?
参考答案:⑴ Fe:5.6g? FeO:3.6g? 3分?⑵ 1? mol/L? ? 3分
本题解析:n=V/Vm=0.1mol
Fe+H2SO4==FeSO4+H2 ↑
1? 1
n Fe? 0.1mol
所以n Fe="0.1" mol,mFe=5.6g,? mFeo=9.2g-5.6g=3.6g,? nFeo=0.05mol
溶质为硫酸亚铁,根据铁元素守恒n FeSO4=0.15mol,所以n H2SO4=0.15mol,C H2SO4=1? mol/L
本题难度:一般