时间:2021-06-11 07:03:52
1、选择题 下列颜色不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色
B.久置的KI溶液呈黄色
C.新制氯水久置后变为无色
D.普通玻璃导管口点燃纯净氢气时,火焰呈黄色
2、选择题 短周期的三种元素a、b、c在周期表中的位置关系如图所示,下列有关这三种元素的叙述中,正确的是( )
A.a是一种活泼金属元素
B.c的最高价氧化物的水化物是强酸
C.b的氢氧化物是强碱
D.c的最高价氧化物对应的水化物是两性氢氧化物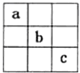
3、选择题 右图为短周期的一部分,推断关于Y、Z、M的说法正确的是
A.非金属性:Y>Z>M
B.气态氢化物的稳定:性Y
D.三种元素中,Y的最高价氧化物对应的水化物酸性最强
4、填空题 J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表; J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。 
(1)M的离子结构示意图为______;元素T在周期表中位于第______族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为____。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为____________。
(4)L的最简单气态氢化物甲的水溶液显碱性。 ①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是____________(选填序号)。 
(5)由J、R形成的液态化合物JR2 0.2 mol在O2中完全燃烧,生成两种气态氧化物,298 K时放出热量215 kJ。该反应的热化学方程式为____。
5、选择题 海洋中有丰富的食品、矿产、能源、药物和水产资源。下图是从海水中提取某些原料的流程图。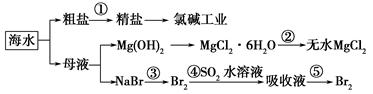
下列有关说法正确的是( )。
A.第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸
B.工业上通过氯碱工业制取金属钠
C.从第③步到第⑤步的目的是浓缩、富集溴单质
D.第②步的反应条件是高温加热