时间:2021-06-11 07:00:58
1、选择题 下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
| pH | c(CrO42—) | c(HCrO4—) | c(Cr2O72—) | c(H2CrO4) |
| 4 | 0.0003 | 0.1040 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0999 | 0.4370 | 0 |
| 7 | 0.2745 | 0.0860 | 0.3195 | 0 |
| 9 | 0.9960 | 0.0031 | 0.0004 | 0 |
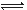 H++HCrO4—
H++HCrO4—参考答案:AC
本题解析:A由表中的数据在PH=4时,c(HCrO4—)= 0.1040可知:铬酸第一级电离方程式为H2CrO4 =H++HCrO4—。错误。B.由表中的数据可知:当PH=9时c(CrO42—)= 0.9960mol/L而c(HCrO4—)、c(Cr2O72—)很小很小。可?见要得到CrO42—应控制溶液的pH>9。正确。C.当电离达到平衡时, v(正)(HCrO4—)= 2v(逆)(Cr2O72—)。错误。D根据Cr守恒可确定c(H2CrO4)= c(CrO42—)+ c(HCrO4—)+2 c(Cr2O72—)= 0.9960+0.0031+0.0004×2=0.9999mol/L.因此该铬酸溶液的物质的量浓度约为1.00mol/L?。正确。2CrO4)溶液中,离子浓度与pH的关系的知识。
本题难度:一般
2、选择题 甲酸和乙酸都是弱酸,当它们的浓度均为0.1mol?L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种不同浓度的甲酸a和b,以及0.10 mol?L-1的乙酸。经测定它们的pH从小到大依次为a、乙酸、b。由此可知
A.a的浓度必小于乙酸的浓度
B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度
D.b的浓度必大于乙酸的浓度
参考答案:C
本题解析:浓度均为0. 1mol/L甲酸与乙酸中,甲酸中c(H+)为乙酸中的3倍可知甲酸的酸性强于乙酸。因pH(a)<pH(乙酸)<pH(b),即溶液中c(H+):a>乙酸>b,所以乙酸浓度大于b的浓度。但不好比较a的浓度与乙酸浓度大小(因甲酸酸性强于乙酸)。
考点:弱电解质电离平衡
点评:注意酸的浓度与c(H+)不同。
本题难度:一般
3、填空题 (2分).已知常温下0.4mol/L的某酸的pH值为3,则由水电离出的OH-浓度为 ,该酸的电离度为: 。
参考答案:略
本题解析:略
本题难度:一般
4、填空题 甲、乙两瓶氨水的浓度分别为1 mol·L-1和0.1 mol·L-1,则甲、乙两瓶氨水中c(OH-)之比__________10(填“大于”“小于”或“等于”),请说明理由:______________________。
参考答案:小于? NH3·H2O是弱电解质,浓度越小电离程度越大
本题解析:设1 mol·L-1和0.1 mol·L-1氨水的电离度分别为α1、α2,(α1<α2),则c1(OH-)∶c2(OH-)=α1∶0.1α2<10。
本题难度:简单
5、选择题 从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测
[? ]
A、HR应为红色
B、HR应为蓝色
C、HR应为无色
D、R-应为红色
参考答案:A
本题解析:
本题难度:一般