时间:2021-06-11 07:00:12
1、选择题 下列有关除杂的叙述正确的是
A.除去苯中的苯酚:加入浓溴水后,过滤
B.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤后分液
C.除去CO2中少量的HCl:气体通过盛有NaOH溶液的洗气瓶
D.除去FeCl3溶液中少量的CuCl2:用足量铁粉,过滤
2、选择题 114号元素的一种同位素是由俄罗斯科学家合成的,存在时间只有30s,其质量数为289,该原子的中子数与电子数之差为
A.61
B.114
C.175
D.289
3、选择题 已知aAn+、bB(n+1)+、cCn-、D(n+1)-均具有相同的电子层结构,关于A、B、C、D四种元素的叙述正确的是(? )
A.原子半径:A>B>C>D
B.原子序数:b>a>c>d
C.离子半径:D>C>B>A
D.金属性:B>A;非金属性:D>C
4、填空题 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为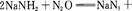
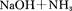
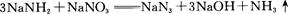 回答下列问题:
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是?,第一电离能最小的元素是?。
(2)基态氮原子的L层电子排布图为?。
(3)与N3-互为等电子体的分子为?(写出一种)。依据价层电子对互斥理论,NO3-的空间构型为?。
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为?。叠氮化钠的水溶液呈碱性,用离子方程式表示其原因:?。
(5)N20沸点(一88.49℃比NH3沸点(一33.34℃)低,其主要原因是?
(6)安全气囊的设计原理为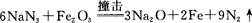
①氮分子中δ键和π键数目之比为?。
②铁晶体中存在的化学键类型为?。
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为
?(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。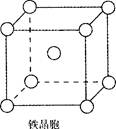
5、选择题 下列说法中,错误的是
A.元素周期表中有7个主族、7个副族
B.碳元素位于第二周期IVA族
C.稀有气体元素原子的最外层电子数均为8个
D.氢分子中的化学键是共价键