时间:2021-06-11 06:52:58
1、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
[? ]
A.对该反应体系加热
B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列说法中错误的是( )
A.加热一般能加快化学反应速率
B.粉碎固体物质能加快化学反应速率
C.不同物质的化学反应速率可能不一样
D.化学方程式中各物质的化学反应速率之比等于其质量比
参考答案:A.加热可使反应的活化分子的百分数增大,反应速率增大,故A正确;
B.粉碎固体物质,固体表面积增大,反应速率增大,故B正确;
C.反应速率之比等于化学计量数之比,不同物质表示的反应速率的大小可能不同,故C正确;
D.化学方程式中各物质的化学反应速率之比等于化学计量数之比,故D错误.
故选:D.
本题解析:
本题难度:简单
3、简答题 科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见表(光照、N2压力1.0×105Pa、反应时间3h):
T/K
303
313
323
353
NH3生成量/(10-6mol)
4.8
5.9
6.0
2.0
相应的热化学方程式如下:N2(g)+3H2O(1)═2NH3(g)+
| 3 2 |

| 4 7 |

参考答案:(1)催化剂是通过降低反应的活化能来加快化学反应速率的,使用催化剂后,活化能降低,故答案为: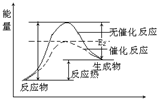
;
(2)根据影响反应速率的因素:温度、浓度、压强、催化剂等外界因素,结合目前广泛使用的工业合成氨方法,可以采用增大压强的方法,此外还可以寻找高效的催化剂,
故答案为:适当增大压强、研究新催化剂;
(3)①设平衡时有x molN2转化? N2(g)+3H2(g))
2NH3(g)
? 起始物质的量:0.6mol? 1.6mol? 0
?变化的物质的量:x? 3x? 2x
? 平衡物质的量:(0.6-x)mol?(1.6-3x)mol? 2x mol
则有:2xmol(2.2-2x)mol=47? 解得:x=0.4(mol)?
故N2的平衡转化率:0.4mol0.6mol=23
②由①可知,N2、H2、NH3平衡时的物质的量分别为:0.2mol、0.4mol、0.8mol,
在2.0L容器中浓度分别为:0.1mol/L、0.2mol/L、0.4mol/L,
K=c(N2)?c3(H2)c2(NH3)=0.1mol/L×(0.2mol/L)3(0.4mol/L)2=5.0×10-3mol2/L2,
答:该条件下N2的平衡转化率为23;该条件下反应2NH3(g)
N2(g)+3H2(g)的平衡常数为5.0×10-3mol2/L2.
本题解析:
本题难度:一般
4、选择题 下列措施是为了降低化学反应速率的是( )
A.食品放在冰箱中贮藏
B.工业炼钢用纯氧代替空气
C.合成氨工业中使用催化剂
D.在加热条件下,用氢气还原氧化铜
参考答案:A.食品放在冰箱中贮藏,温度低,反应速率降低,故A选;
B.工业炼钢用纯氧代替空气,反应物浓度增大,反应速率加快,故B不选;
C.合成氨工业中使用催化剂,降低反应所需的活化能,反应速率加快,故C不选;
D.在加热条件下,用氢气还原氧化铜,温度升高,反应速率加快,故D不选;
故选A.
本题解析:
本题难度:一般
5、填空题 (I)下图是工业生产硝酸铵的流程。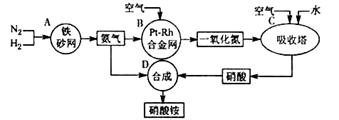
(1)吸收塔C中通入空气的目的是 。A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) +6H2O(g) △H =-1266.8kJ/mol
N2(g) + O2(g) = 2NO(g) △H =" +180.5" kJ/mol
写出氨高温催化氧化的热化学方程式:
(II)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(3)该反应的离子方程式为___________________________________________________。
(4)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物有催化作用 D.反应物接触面积增大
(5)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol·L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | _______ | _______ | 实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② | 5 | 20 | 0.5 | 0 | |
| ③ | 5 | 20 | 0 | 0.5 |
参考答案:(I)(1)使NO全部转化成HNO3 (或提供O2氧化NO)(2分); ABC(2分)(少1个扣1分,多1个没有分)
(2)4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905.8kJ/mol(3分)
4NO(g)+6H2O(g) △H=-905.8kJ/mol(3分)
(II)(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (3分)
(4)AC(2分)
(5)温度不是反应速率明显加快的主要原因。(2分)
(6)(2分)
实验编号
铜片
质量/g
0.1mol·L-1的
硝酸体积/mL
硝酸铜
晶体/g
亚硝酸钠
晶体/g
实验目的
①
5
20
0
0
实验①和②探究
Cu2+ 的影响;实验①和③探究亚硝酸根的影响。
②
5
20
0.5
0
③
5
20
0
0.5
本题解析:
试题分析:(1)在整个生产流程中,第一次通入空气为了提高氨气的转化率,第二次是为了提高一氧化氮生成硝酸的转化率;整个流程中涉及的反应方程式有:①N2+3H2?2NH3②4NH3+5O2 =4NO+6H2O③2NO+O2
本题难度:困难