时间:2021-06-11 06:52:16
1、选择题 化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题。下列实验问题处理方法正确的是
[? ]
A.制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热
B.在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度
C.白磷在空气中易自燃,用剩的白磷可溶解于CS2后倒入垃圾箱
D.给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷未发生水解 |
| D | 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热 | 未出现砖红色沉淀 | Y中不含有醛基 |
参考答案:B
本题解析:A不能排除SO32-离子的干扰,错误;B中等体积等PH值,弱酸中在反应过程中氢离子浓度较大,反应速率快,正确;C溴乙烷与NaOH溶液共热后溶液呈碱性,会和硝酸银发生反应,正确操作方法加硝酸中和后,再滴加AgNO3溶液,错误;D向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,由于NaOH溶液较少溶液呈酸性,必须是新制的氢氧化铜悬浊液呈碱性才能氧化酫基,错误;
本题难度:一般
3、选择题 实验是研究化学的基础,下图中所示的实验方法,装置和操作完全正确的是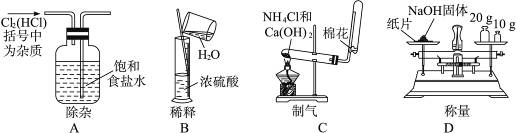
参考答案:C
本题解析:A项应为长进短出,B 项应在烧杯中稀释浓硫酸,并且应把浓硫酸倒入水中,不应把水倒入浓硫酸中,D项不应把NaOH固体放在纸片上称量,应放在已知质量的小烧杯内或表面皿上称量。
本题难度:简单
4、选择题 若在试管中加入2~3mL液体再加热,正确的操作顺序是( )
①点燃酒精灯进行加热;②在试管中加入2~3mL液体;③用试管夹夹持在试管的中上部;④将试剂瓶的瓶盖盖好,放在原处.
A.②③④①
B.③②④①
C.②④③①
D.③②①④
参考答案:若在试管中加入2-3毫升液体再加热,应先在试管中加入2-3毫升液体;再将试剂瓶的瓶盖盖好,放在原处;再用试管夹夹在试管的中上部;最后点燃酒精灯进行加热.注意加热前要先预热.所以正确的顺序是②④③①.
故选C.
本题解析:
本题难度:一般
5、选择题 下列实验操作或结论正确的是?
[? ]
参考答案:A
本题解析:
本题难度:简单