时间:2021-06-11 06:45:52
1、选择题 一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通入乙烷和氧气。电极反应式为:C2H6 +180H- -14e-="=" 2C032一+ 12H20;? 7H20+7/2 02+14e - ="=140H" -.
下列有关此电池的推断错误的是?(?)
A.通氧气的电极为正极
B.参加反应的02与C2H6的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中OH -向正极移动
参考答案:D
本题解析:略
本题难度:简单
2、选择题 银锌电池的充电和放电过程可表示为: 2Ag+Zn(OH)2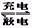 Ag2O+Zn+2H2O,此电池放电时,负极上发生反应的物质是(? )
Ag2O+Zn+2H2O,此电池放电时,负极上发生反应的物质是(? )
A.Ag
B.Zn(OH)2
C.Ag2O
D.Zn
参考答案:D
本题解析:根据原电池工作原理,负极上发生氧化反应.元素化合价会升高,所以在放电过程中被氧化的是Zn,即Zn为负极.
本题难度:一般
3、选择题 锂钒氧化物电池的能量密度远远超过其它材料电池,其成本低,便于大量推广,
且对环境无污染。电池总反应式为:V2O5+xLi==LixV2O5。下列说法中,不正确的是(?)
A.正极材料为锂,负极材料为V2O5
B.向外供电时,锂离子在凝胶中向正极移动
C.正极的电极反应式为:V2O5 + xLi++ xe—="=" LixV2O5
D.负极的电极反应式为:xLi—xe—==xLi+
参考答案:A
本题解析:由总反应V2O5+xLi==LixV2O5的化合价改变可知,锂升高,失电子,为负极材料:xLi—xe—==xLi+,而V元素的化合价降低,V2O5得电子,为正极材料:V2O5 + xLi++ xe—="=" LixV2O5
故答案为A
本题难度:简单
4、选择题 燃料电池突出的优点是不经过热能的中间形式而进行能量转化,现已广泛使用.如甲烷燃料电池,其电极反应为:负极:CH4+10OH-→CO32-+7H2O+8e-,正极:O2+4e-+2H2O→4OH-,现已知此燃料电池工作时得到了54毫升水,则电池的电子转移为( )
A.12mol
B.8mol
C.4mol
D.2mol
参考答案:CH4+10OH--8e-=CO32-+7H2O ①
2O2+8e-+4H2O=8OH-?②
将方程式①+②得 CH4 +2OH-+2O2=3H2O+CO32-转移电子
?54g? 8mol
即此燃料电池工作时得到了54毫升水,则电池的电子转移为8mol.
故选B.
本题解析:
本题难度:一般
5、选择题 氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是(
| 1 2 |

参考答案:A.放电时电池负极反应为H2-2e-+2OH-=2H2O,电池负极周围溶液的OH不断减小,故A错误;
B.电池放电时,正极反应为:NiO(OH)+H2O+e-=OH-+Ni(OH)2,镍元素被还原,故B错误;
C.充电时,阴极反应为,2H2O+2e-=H2+2OH-,氢元素被还原,故C正确;
D.电池放电时,负极反应为H2-2e-+2OH-=2H2O,H2是负极,故D正确.
故选CD.
本题解析:
本题难度:简单