时间:2021-06-11 06:43:58
1、选择题 X、Y是元素周期表ⅦA族中的两种元素。下列叙述中不能说明X的非金属性比Y强的
A.X气态氢化的酸性比Y的气态氢化物的酸性强
B.惰性电极电解NaX和NaY的混合液时,先产生Y2
C.X的气态氢化物比Y的气态氢化物稳定
D.X的单质能将Y从NaY的溶液中置换出来
参考答案:A
本题解析:比较两元素的非金属性和强弱,有多种方法
A.由于元素的非金属性与其氢化物的酸碱性没有一定的关系,故此选项不正确
B.电解时,阴离子越易放电,越易失电子,还原性越强,对应的元素的非金属性越差
C.气态氢化物的稳定性越好,对应元素的非金属性越强
D.X可置换出Y单质,说明X相对更易得电子,非金属性相对较强
故答案为A
本题难度:一般
2、选择题 甲、乙为短周期元素的单质,丙、丁为氧化物,它们存在如下转化关系: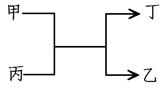
则甲和乙可以是
A.钠和氢气
B.镁和碳
C.氧气和硫
D.铝和铁
参考答案:B
本题解析:选项A,若甲为Na,乙为H2,则丙为H2O,丁为NaOH,NaOH不是氧化物,符合题意。选项B,若甲为Mg,乙为C,则丙为CO2,丁为MgO,符合题意。选项C,若甲为O2,乙为S,则丙为H2S,丁为H2O,H2S不是氧化物,不符合题意。选项D,铁不是短周期元素,不符合题意。
本题难度:一般
3、选择题 下列有关性质的比较中,正确的是?(?)
A.热稳定性:H2S>HCl>HBr>HI
B.熔点:Na2O >MgO>CaO
C.微粒半径:F-<Na+<Mg2+
D.还原性:H2S>HCl >HF
参考答案:D
本题解析:略
本题难度:简单
4、计算题 某二价金属的同位素的碳酸盐(MCO3)粉末4g,放到50mL 1mol/L的稀硫酸中,有无色略带酸味的气体缓慢生成,同时生成新的不溶物。向滤液中加入60mL 1mol/L得氢氧化钠溶液后,溶液的pH=7,求这种同位素的质量数;若其原子核内的中子数为质子数的1.5倍。
通过计算确定
(1)该同位素原子核内的质子数和中子数并写出该原子组成符号
(2)该元素在周期表中的位置
参考答案:32.?14056Ba?第六周期?第ⅡA
本题解析:略
本题难度:简单
5、选择题 下列有关原子结构和元素周期律的表述正确的是
A.原子序数为15的元素最高化合价为+5
B.同周期元素中,VIIA族元素是非金属性最强的元素
C.氧原子半径比氟原子半径大
D.原子序数为12的元素位于元素周期表的第三周期IIA族
参考答案:ABCD
本题解析:原子序数为15的元素是磷元素,其核外电子排布为2 8 5,最高化合价=最外层电子数,故A正确;
同周期,由左到右,原子的得电子能力逐渐增强,则元素的非金属性逐渐增强(惰性气体元素除外),故B正确;
同周期,由左到右,原子半径逐渐减小,故C正确;
原子序数为12的元素是镁元素,其核外电子排布为2 8 2,周期序数=电子层数、主族序数=最外层电子数,故D正确;
本题难度:一般