时间:2021-06-11 06:43:58
1、填空题 (6分)A、B、C、D、E是中学化学常见的分子或离子,它们核外都有10个电子,且A是由5个原子核组成的粒子。它们之间可发生如下变化:A+B===C+D;B+E===2D,且D与大多数酸性氧化物及碱性氧化物均能反应。
(1)A的电子式:____________B的电子式:____________
(2)E的化学式为:__________
(3)用电子式表示D的形成过程:?
(4)实验室制取C的方程式:?
参考答案:(1)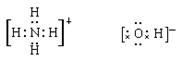 (2)H3O+
(2)H3O+
(3)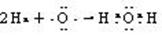
(4)Ca(OH)2+2NH4Cl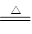 CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
本题解析:10电子5核的微粒是NH4+,即A是NH4+。因为NH4+可与10电子的OH-反应生成10电子的H2O和10电子的NH3,所以B是OH-,OH-与H3O+反应生成2分子的水,所以CDE分别是氨气、水、H3O+。
本题难度:一般
2、选择题 右表代表周期表中的几种短周期元素,下列说法中错误的是(?)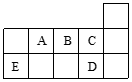 A.C、D气态氢化物稳定性强弱和沸点高低均为C>D
A.C、D气态氢化物稳定性强弱和沸点高低均为C>D
B.A、B、C第一电离能的大小顺序为C>B>A
C.AD3和ED4两分子的中心原子均为sp3杂化
D.ED4分子中各原子均达8 电子结构
参考答案:B
本题解析:根据元素再周期表中位置可知,A是N、B是O、C是F、D是Cl、E是Si。非金属性越强,第一电离能越大,但用于氮原子的2p轨道电子是半充满状态,稳定性强,所以第一电离能大于O的,B不正确,其余都是正确的,答案选B。
本题难度:一般
3、计算题 由第IIA族金属单质A和第IIIA族金属单质B组成的混合物1.29g ,用过量的盐酸其完全溶解后生成的氢气 在标况下的体积为1.456L.若A和B的原子量之比为8:9,混合物中A和B的原子个数比为2:3,求A、B的的相对原子质量。
在标况下的体积为1.456L.若A和B的原子量之比为8:9,混合物中A和B的原子个数比为2:3,求A、B的的相对原子质量。
参考答案:
本题解析:略
本题难度:简单
4、选择题 下列有关电子云及示意图的说法正确的是(?)
A.电子云是笼罩在原子核外的云雾
B.小黑点多的区域表示电子多
C.小黑点疏的区域表示电子出现的机会少
D.电子云是用高速照相机拍摄的照片
参考答案:
 C
C
本题解析:考查电子云的概念及有关判断。电子云是电子在原子核外空间概率密度分布的形象化描述,电子在原子核外空间的某区域内出现,好像带负电荷的云笼罩在原子核的周围,人们形象地称它为“电子云”。电子云就是用小黑点疏密来表示空间各电子出现概率大小的一种图形。小黑点表示电子在核外空间某处出现的机会,不代表电子的运动轨迹;小黑点的疏密表示出现机会的多少,密则机会大,疏则机会小,所以正确的答案选C。
本题难度:简单
5、填空题 (19分)下表是元素周期表的一部分,回答下列有关问题:(填写元素符号或化学式)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ? | ? | ? | ? | ① | ? | ② | ? |
| 3 | ③ | ④ | ⑤ | ⑥ | ? | ⑦ | ⑧ | ? |
| 4[] | ⑨ | ? | ? | ? | ? | ? | ⑩ | ? |
参考答案:(1)N? Si? S? Cl?(2)K? F?(3)HClO4? KOH? Al(OH)3
2NH4Cl+Ca(OH)2 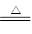 ?CaCl2+2NH3↑+2H2O
?CaCl2+2NH3↑+2H2O
(4)黄色,棕色成剂瓶用水封
(5)Na, 2Na+2H2O ="==" 2Na(OH)2+H2↑(其他合理也给分)Mg+2H2O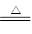 Mg(OH)2+H2↑
Mg(OH)2+H2↑
Cl,? Cl2+2NaBr ="==" Br2+2NaCl(其他合理也给分)
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表做的位置可判断①是N、②是F、③是Na、④是Mg、⑤是Al、⑥是Si、⑦是S、⑧是Cl、⑨是K、⑩是Br。同主族元素自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。同周期元素自左向右原子半径逐渐减小,非金属性逐渐增强,金属性逐渐减弱。
本题难度:一般