时间:2021-06-11 06:41:23
1、选择题 某混合溶液中所含离子的物质的量浓度如下表,则M2+可能为(?)
| 所含离子 | Cl- | SO42- | H+ | Mn+ |
| 物质的量浓度mol/L | 2 | 1 | 2 | 1 |
参考答案:A
本题解析:根据电荷守恒可得:2(-1)+1(-2)+2(+1)+1(+n)=0,n=2。另外要注意Ba2+与SO42-在溶液中不能大量共存。
点评:溶液呈电中性,溶液中阴、阳离子电荷总数为0。
本题难度:简单
2、选择题 设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1mol乙基中含有的电子数为17NA
B.标准状况下,22.4L三氯甲烷中共价键数目为4NA
C.1mol硫粉与足量的Cu粉共热,转移的电子数为1NA
D.7.8gNa2O2晶体中含有阴阳离子总数为0.4NA
参考答案:A
本题解析:A.正确
B.三氯甲烷为液态,不适合气体的摩尔体积,不正确
C.1mol硫粉与足量的Cu粉共热,硫由0价降至—2价,转移的电子数为2NA,排除
D.Na2O2晶体中含有的是钠离子与过氧酸根离子,故7.8gNa2O2晶体中含有阴阳离子总数为0.3NA,排除
答案为A
本题难度:简单
3、实验题 (13分)FeSO4?7H2O广泛用于医药和工业领域。以下是FeSO4?7H2O的实验室制备流程图。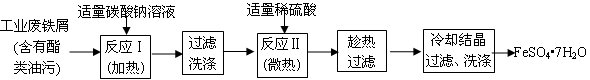
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为 (用离子方程式表示)。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答) , 。
以下是测定某补血剂(FeSO4?7H2O)中铁元素含量的流程图。根据题意完成下列填空: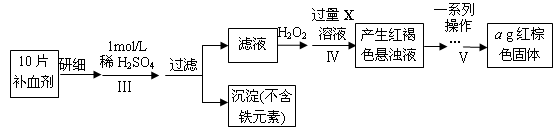
(3)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。
(4)步骤Ⅴ一系列操作依次是:①过滤②洗涤③ ④冷却⑤称量⑥恒重操作。操作⑥的目的是 。
(5)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
参考答案:(1)CO32—+H2O HCO3—+OH—;(2分)(2)Fe2O3 +6H+=2Fe3++3H2O(2分)
HCO3—+OH—;(2分)(2)Fe2O3 +6H+=2Fe3++3H2O(2分)
2Fe3+ +Fe=3Fe2+ (2分) (3) 100mL容量瓶 (1分) (4)③灼烧(加热)(2分)
恒重操作确保氢氧化铁完全分解成了氧化铁 (2分) (5) 0.07a(2分)
本题解析:(1)碳酸钠是强碱弱酸盐,水解溶液显碱性,因此可以除去油污,方程式为CO32—+H2O HCO3—+OH—;
HCO3—+OH—;
(2)氧化铁与稀硫酸反应生成硫酸铁,硫酸铁又与铁反应生成硫酸亚铁,因此废铁屑中含氧化铁,无需在制备前除去,反应的离子方程式为Fe2O3 +6H+=2Fe3++3H2O、 2Fe3+ +Fe=3Fe2+。
(3)配制100mL1mol/L的稀硫酸需要的仪器有量筒、烧杯、玻璃棒、胶头滴管及 100mL容量瓶。
(4)红褐色沉淀是氢氧化铁,灼烧即得到氧化铁。为保证氢氧化铁完全分解转化为氧化铁,需要恒重操作。
(5)氧化铁的质量是ag,则根据铁元素守恒可知每片补血剂含铁元素的质量=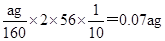 。
。
考点:考查元素含量测定实验方案设计与探究
本题难度:困难
4、选择题 下列说法一定正确的是
A.反应A(s) 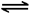 2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态
2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态
B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀
C.将33.6LNO2溶于D2O中得到1L溶液,该溶液的物质的量浓度为1.0mol/L
D.在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023
参考答案:D
本题解析:A.因为该反应的气体都是生成物,无论反应是否达到平衡,各种气体的体积分数都不会发生变化。错误。B.若要通过外加电源来保护钢闸门,防止钢闸门腐蚀,应该将钢闸门与直流电源的负极相连。这就是外接电源的阴极保护法。错误。C. 3NO2+H2O=2HNO3+NO. 因为不知道NO2是在什么条件下的体积所以物质的量不确定,无法知道HNO3的物质的量。浓度无法计算。错误。D. 根据质量守恒定律,任何元素在反应前后质量不变,原子的个数也不变。n(SO3)=m/M=80g÷80g/mol=1mol,所以n(O)=3mol.N(O)=3NA=3×6.02×1023.正确。
本题难度:一般
5、填空题 (1)5.4克H2O含有______molH.
(2)3.01×1024个OH-与______molNH3的质量相同.
(3)15.6gNa2X中含Na+0.4mol,则X的相对原子质量是______.
(4)3.6g重水2H2O含电子物质的量为______.
(5)在一定温度和压强下,3L气体A2跟9L体积的气体B2完全化合生成6L体积某气体C,则该气体C的化学式为(用A、B表示)______.
参考答案:(1)水的n=mM=5.4g18g/mol=0.3mol,每个分子中含有2个H,所以5.4克H2O含有0.6molH,故答案为:0.6;
(2)n(NH3)=3.01×10246.02×1023mol×17g/mol17g/mol=5mol,故答案为:5;
(3)根据钠离子和Na2X的关系式得n(Na2X)=12n(Na+)=0.2mol,M(X)=15.6g0.2mol-2×23g/mol=32g/mol,
摩尔质量在数值上等于其相对原子质量,所以X的相对原子质量是32,
故答案为:32;
(4)重水的物质的量=3.6g20g/mol=0.18mol,每个重水分子中含有10个电子,所以3.6g重水2H2O含电子物质的量为1.8mol,故答案为:1.8mol;
(5)同一条件下,参加反应的气体的体积之比等于其计量数之比,则A2、B2、C的计量数之比=3L:9L:6L=1:3:2,该方程式为A2+3B2=2C,根据原子守恒知,C的化学式为AB3或B3A,故答案为:AB3或B3A.
本题解析:
本题难度:一般