时间:2021-06-11 06:30:59
1、选择题 下列各组物质均属于硅酸盐工业产品的是(?)
A.陶瓷、水泥
B.单晶硅、玻璃
C.普钙、漂白粉
D.石英玻璃、石膏
参考答案:A
本题解析:选项中只有陶瓷、水泥、玻璃属硅酸盐工业产品。
本题难度:简单
2、选择题 美国科学家用有机分子和球形笼状分子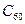 ,首次制成了“纳米车”(如图.每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
,首次制成了“纳米车”(如图.每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是


A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进人一个新阶段
C.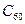 是一种新型化合物
是一种新型化合物
D.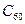 熔点比金刚石熔点高
熔点比金刚石熔点高
参考答案:B
本题解析:纳米车不可能用肉眼直接看到,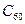 是单质,是一种分子晶体,熔点不可能高于金刚石。
是单质,是一种分子晶体,熔点不可能高于金刚石。
本题难度:一般
3、计算题 (10分) 将KOH和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2?的体积为224mL(标准状况,忽略CO2溶于水情况。以下情况相同。)

 ?
?
(1)生成沉淀的质量刚好最大时,反应的方程式为:? __________________?
(2)原混合物中Ca(OH)2的质量为? _________?g。
(3)沉淀恰好溶解时,消耗CO2的体积为? __________?mL
(4)写出溶液中生成沉淀的质量m(g)与通入CO2的体积V(mL)之间的函数表达式。
| V的取值范围 | m=f(V) |
| ? | ? |
| ? | ? |
| ? | ? |


 ?
?
参考答案:(1)CO2+Ca(OH)2→CaCO3↓+H?2O(1分)

 ?
?
(2)0.74g(2分)
(3)896mL(2分)
(4)(3分)
V的取值范围
m=f(V)
0≤V<224
m=V/224
224≤V≤672
m=1
672≤V≤896
m=1-(V-672)/224
(5)(2分)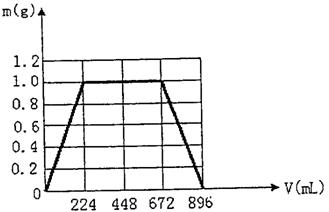
本题解析:略
本题难度:简单
4、填空题 硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有?。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: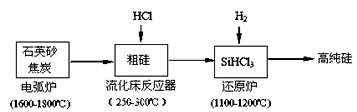
①工业上用石英砂和焦炭在电弧炉中高温加热到1600℃-1800℃除生成粗硅外,也可以生产碳化硅,则在电弧炉内可能发生的反应的化学方程式为?。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,粗硅生成SiHCl3的化学反应方程式?。
(3)有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和?;SiHCl3极易水解,其完全水解的产物为?。
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
参考答案:(1)石英砂、纯碱和石灰石(2分)
(2)①SiO2 + 2C Si + 2CO↑(2分)、SiO2 + 3C
Si + 2CO↑(2分)、SiO2 + 3C SiC + 2CO↑(2分)
SiC + 2CO↑(2分)
②Si + 3HCl SiHCl3 + H2(2分)
SiHCl3 + H2(2分)
(3)蒸馏(1分)? H4SiO4(或H2SiO3)、H2、HCl(2分,答不全,少一种扣一分,但有错不给分)
(4)SiHCl3 + H2 ?Si + 3HCl (2分)
?Si + 3HCl (2分)
(5)H2、HCl(2分)
本题解析:(1)生产普通玻璃的主要原料有石英砂、纯碱和石灰石
(2)①石英砂的主要成分是SiO2,与C可能的反应有:SiO2 + 2C Si + 2CO↑、SiO2 + 3C
Si + 2CO↑、SiO2 + 3C SiC + 2CO↑
SiC + 2CO↑
②粗硅生成SiHCl3的化学反应方程式为Si + 3HCl SiHCl3 + H2
SiHCl3 + H2
(3)硅的氯化物的熔点相差较大且互溶,所以采用蒸馏的方法可提纯SiHCl3,从元素的种类上分析SiHCl3完全水解的产物有H4SiO4(或H2SiO3)、H2、HCl
(4)还原炉中发生的反应是氢气还原SiHCl3,化学方程式为SiHCl3 + H2 ?Si + 3HCl
?Si + 3HCl
(5)氯碱工业的产品有H2、Cl2、NaOH,所以为上述工艺生产提供部分原料是H2、HCl
本题难度:困难
5、填空题 生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO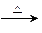 CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。试计算:
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。试计算:
(1)原混合气体中甲烷的物质的量是____________;二氧化碳的质量是?。
(2)原混合气体中氮气的体积分数为?。
参考答案:(1)0.075mol(2分);0.44g(2分)(2)5.56%(2分)。
解析:由于硬质玻璃管减少的质量为CuO中的氧的质量,所以n(CuO)==0.3mol,由方程式可知反应的CH4的物质的量为0.075mol。生成的CO2也为0.075mol,将气体通过澄清的石灰水生成8.5g沉淀,所以n(CO2)=0.085mol,原混合气体中的n(CO2)=0.01mol,而气体的总物质的量为:=0.09mol,所以n(N2)=0.005mol,N2的体积分数为:×100%=5.56%。
本题解析:略
本题难度:一般