时间:2021-06-11 06:30:38
1、选择题 在一定条件下,密闭容器中发生可逆反应2X(g)+2Y(g) 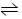 3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是?(?)?
3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是?(?)?
A c(Z)=0.75 mol·L-1? B c(Z)=1.2 mol·L-1
C c(W)=0.80 mol·L-1? D c(W)=1.0 mol·L-1
参考答案:D
本题解析:
答案:D
2X(g)+2Y(g) 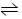 3Z(g)+2W(g)
3Z(g)+2W(g)
3.0? 1.0? 1.5? 1.0
c(Z)<1.5 mol·L-1, c(W)<1.0 mol·L-1,所以D选项不可能。
本题难度:简单
2、选择题 在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)?CO(g)+H2(g);
乙:CO(g)+H2O(g)?CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变 ⑦单位时间内,消耗水质量与生成氢气质量比为9:1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤
B.③④⑥
C.⑥⑦
D.④⑤
参考答案::①混合气体平均相对分子质量不再改变,由于乙反应的两边气体的体积相同且都是气体,压强始终不变,所以平均相对分子质量始终不变,无法判断乙反应是否达到平衡状态,故①错误;
②恒温时,气体压强不再改变,乙反应的两边气体的体积相同且都是气体,压强始终不变,所以压强不变无法判断乙是否达到平衡状态,故②错误;
③各气体组成浓度相等,不能判断各组分的浓度不变,无法证明达到了平衡状态,故③错误;
④反应体系中温度保持不变,说明正逆反应速率相等,达到了平衡状态,故④正确;
⑤断裂氢氧键速率是断裂氢氢键速率的2倍,说明正逆反应速率相等,达到了平衡状态,故⑤正确;
⑥混合气体密度不变,由于乙反应的两边气体的体积相同且都是气体,容器的容积不变,所以密度始终不变,无法判断乙是否达到平衡状态,故⑥错误;
⑦单位时间内,消耗水质量与生成氢气质量比为9:1,水与氢气的物质的量之比为1:1,表示的都是正逆反应速率,无法判断正逆反应速率相等,故⑦错误;
故选D.
本题解析:
本题难度:一般
3、选择题 在一定条件下,可逆反应A(g)+B(g)═2C(g)一定达到平衡的标志是( )
A.B的生成速率与A的消耗速率相等
B.体系的质量不再发生变化
C.A、B、C的浓度之比为1:1:2
D.每消耗1mol A同时生成2mol C
参考答案:A.当B的生成速率与A的消耗速率相等时,该反应达到平衡状态,故A正确;
B.根据质量守恒定律知,无论该反应是否达到平衡状态,该体系的质量始终不变,所以不能判断该反应是否达到平衡状态,故B错误;
C.平衡时A、B、C的浓度之比可能为1:1:2,可能不是1:1:2,与反应物的起始物浓度、转化率有关,故C错误;
D.无论反应是否达到平衡状态,每消耗1mol A同时生成2mol C,所以不能判断该反应是否达到平衡状态,故D错误;
故选A.
本题解析:
本题难度:简单
4、选择题 下图是可逆反应X2+3Y2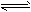 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是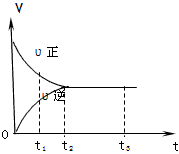
[? ]
A.t1时,只有正方向反应
B.t2时,X2、Y2、Z2的物质的量相等
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
参考答案:D
本题解析:
本题难度:一般
5、选择题 一定温度下,可逆反应3X(g)+Y(g)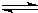
2Z(g)达到限度的标志是( )
A.单位时间内生成3nmolX,同时消耗nmolY
B.X、Y、Z的浓度相等
C.X的生成速率与Z的生成速率相等
D.X、Y、Z的分子个数比为3:1:2
参考答案:A.单位时间内生成3nmolX,同时消耗nmolY,可说明正逆反应速率相等,达到平衡状态,故A正确;
B.平衡时各物质的浓度取决于反应开始时的配料比以及反应转化的程度,不能用来判断是否达到平衡状态,故B错误;
C.X的生成速率与Z的生成速率相等,则正逆反应速率不等,没有达到平衡状态,故C错误;
D.平衡时各物质的分子数关系取决于反应起始物质的量以及转化的程度,不能用来判断是否达到平衡状态,故D错误.
故选A.
本题解析:
本题难度:一般