时间:2021-06-11 06:27:25
1、实验题 (8分)某工厂为除去所排放废气中的Cl2对环境的污染,设计如下除氯方案:将含Cl2的废气通过盛有铁粉的FeCl3溶液即可有效除去Cl2,整个过程只要定期补充铁粉即可。写出除氯过程中有关反应的化学方程式,并指出本方案的优点。
参考答案:2FeCl2+Cl2====2FeCl3? 2FeCl3+Fe====3FeCl2,本实验方案的优点:在整个消除Cl2的过程中,只消耗廉价的铁屑,且FeCl2可循环使用。
本题解析:本实验方案的目的是:消除Cl2对环境的污染,因此一定要将Cl2转化为无毒的Cl-,这是解答本题的出发点。
本题难度:简单
2、选择题 下列实验方法不能达到目的的是?(?)
A.用加热的方法分离氯化钠和氯化铵的固体混和物
B.用水鉴别乙醛、苯、硝基苯
C.用核磁共振氢谱鉴定未知物C2H6O的分子结构
D.用10mL量筒量取5.00mL1.00 mol·L-1盐酸配制0.100mol·L-1盐酸
参考答案:D
本题解析:略
本题难度:简单
3、实验题 (15分)为研究铁质材料与热浓硫酸的反应,某小组进行了以下探究活动:
[探究一]
(1)称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中是否含有Fe2+,应选择加入的试剂为____?(选填序号)。?
a.KSCN溶液和氯水? b.铁粉和KSCN溶液
c.浓氨水? d.酸性KMnO4溶液
②乙同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。据此推知气体Y?中SO2的体积分数为____?。(相对原子质量:O—16? S—32? Ba—137)
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。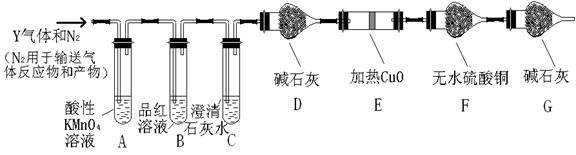
(2)写出产生CO2的化学方程式___?_。
(3)装置A中试剂的作用是____?。
(4)简述确认气体Y中含有CO2的实验现象?。
(5)如果气体Y中含有H2,预计实验现象应是?。
参考答案:(15分)(1)①d (1分) ?②66.7%(或其它合理答案)(2分)
(2)?C+H2SO4(浓)?CO2↑+SO2↑+2H2O(3分)
(3)除去混合气体中的SO2(3分)
(4)C中澄清的石灰水变浑浊(3分)
(5)E中固体由黑变红和F中固体由白变蓝(3分)
本题解析:略
本题难度:一般
4、选择题 为探究一溴环己烷( )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。其中正确的是
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。其中正确的是
[? ]
A.甲
B.乙
C.丙
D.上述实验方案都不正确
参考答案:D
本题解析:
本题难度:简单
5、实验题 下图所示是完成1,2-二氯乙烷某些性质得实验装置。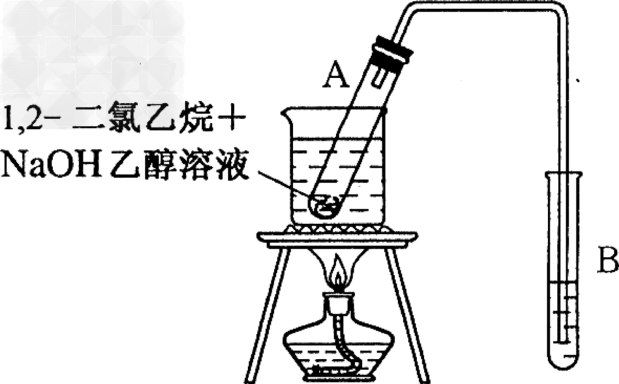
(1)按图所示连接好仪器后,首先应进行的操作是_______________
(2)在试管A里加入2?mL?1,2-二氯乙烷和5mLl0%的NaOH乙醇溶液,再向试管里加入几小块碎瓷片。加入碎瓷片的作用是________________?。
(3)用水浴加热试管A里的混合物(其主要生成物仍为卤代烃),试管A中发生反应的化学方程式是_____________,其反应类型是__________。
(4)为检验产生的气体,可在试管B中盛放______________,现象是_____________;向反应后试管A中的溶液里加入足量的稀硝酸,再加入几滴AgNO3溶液,现象是_____________?。
参考答案:(1)检查装置的气密性?
(2)防止暴沸
(3)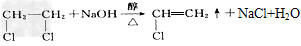 ;消去反应?
;消去反应?
(4)溴水或高锰酸钾酸性溶液;溶液褪色;产生白色沉淀
本题解析:
本题难度:一般