时间:2021-06-11 06:26:58
1、选择题 用NA表示阿伏加德罗常数,下列叙述中正确的是
A.12g的金刚石晶体中含有碳碳键的数目为4NA
B.46g四氧化二氮含有的原子总数一定为3NA
C.500mLl.0mol/L的乙酸溶液中含有的H+数为0.5NA
D.1 molFeCl3制成胶体,所得胶体的粒子数为NA
参考答案:B
本题解析:金刚石中每个碳原子形成的共价键是4÷2=2个,因此A不正确,应该是2NA。由于NO2和N2O4的最简式相同,所以选项B正确。醋酸是弱酸,存在电离平衡,氢离子的物质的量小于0.5NA,C不正确。生成氢氧化铁胶体的反应是可逆反应,所以所得胶体的粒子数小于NA,D不正确。答案选B。
本题难度:一般
2、选择题 NA表示阿伏加德罗常数,下列叙述正确的是
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol ? L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na202固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6 NA
参考答案:D
本题解析:A项lmol FeI2与足量氯气反应时转移的电子数应该为3NA(Fe2+、I-均被氧化),错误;B项2 L0.5 mol ? L-1硫酸钾溶液中SO42-所带电荷数应该为2NA,错误;C项1 mol Na202固体中含离子总数应该为3NA,错误。D项丙烯和环丙烷为同分异构体,故42 g混合气体中氢原子的个数为6 NA,正确。
本题难度:一般
3、选择题 设NA为阿伏伽德罗常数的值。下列叙述不正确的是
A.18gNH4+ 中含有的电子数为10NA
B.常温常压下,10g氖气所含原子数为0.5NA(相对原子质量:Ne 20)
C.1L 0.1 mol/L醋酸溶液中含有的氢离子数为0. 1NA
D.标准状况下,2.24L已烷含有分子的数目为0.1NA
参考答案:CD
本题解析:
答案:C D
A、B正确;
C、不正确,醋酸是弱电解质,难电离,1L 0.1 mol/L醋酸溶液中含有的氢离子数远少于0. 1NA
D.不正确,标准状况下,已烷是液体。
本题难度:一般
4、选择题 36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1)所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数的数值,则下列叙述中正确的是? ( )。
A.所得溶液的物质的量浓度为1 mol·L-1
B.所得溶液中含有NA个HCl分子
C.36.5 g HCl气体占有的体积为22.4 L
D.所得溶液的质量分数:w=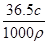
参考答案:D
本题解析:溶质为36.5 g HCl,物质的量为1 mol。溶剂水的体积为1 L,溶液体积并非1 L,A项错;HCl是强电解质,溶于水后完全电离,溶液中不存在HCl分子,B项错;36.5 g HCl气体在标准状况下占有的体积为22.4 L,C项错;假设溶液体积为1 L,则溶液总质量为(1 000ρ)g,溶质的质量为36.5c g,则所得溶液的质量分数:w=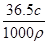 。所以D项正确。
。所以D项正确。
本题难度:一般
5、选择题 下列说法中,正确的是
A.1 mol氢原子的质量是 2 g
B.含0.5 mol硫酸的溶液,H2SO4分子的数目是6.02×1023个
C.28 g CO与32 g O2所含质子数相等
D.6.02×1023个氧原子的质量是16 g
参考答案:D
本题解析:氢原子的摩尔质量为1 g/mol,所以1 mol氢原子的质量是 1 g,故A错误;含0.5 mol硫酸的溶液,H2SO4分子的数目是0.5×6.02×1023个,故B项错误;28 g CO的物质的量为1mol,含质子14 mol,32 g O2的物质的量为1mol,含质子16 mol,故C错误;6.02×1023个氧原子是1mol氧原子,质量为16g,故D正确。
考点:本题考查物质的量。
本题难度:一般