时间:2021-06-11 06:26:16
1、选择题 常温下某溶液中水电离出的C(H+) = 1×10-13 mol/L,则下列说法中正确的是
A.该溶液一定呈酸性
B.该溶液一定呈碱性
C.该溶液中一定有C(OH-) = 0.1mol/L
D.该溶液的pH值为1或13
参考答案:D
本题解析:常温下某溶液中水电离出的C(H+) = 1×10-13 mol/L,说明该溶液中水的电离是被抑制的,所以溶液可能显酸性,也可能显碱性,D正确。答案选D。
本题难度:一般
2、选择题 在CH3COONa溶液中,各离子的浓度由大到小排列顺序正确的是( )
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
参考答案:A
本题解析:醋酸钠是强碱弱酸盐,CH3COO-水解,溶液显碱性。所以根据盐类水解的特点和电荷守恒可知,正确的顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),答案选A。
点评:该题是基础性试题的考查,也是高考中的常见题型。试题侧重对学生基础知识的巩固和训练,旨在提高学生的应试能力和学习效率,也有利于培养学生的逻辑推理能力。
本题难度:简单
3、填空题 (14分)已知25℃、101kPa下,氢气、甲烷和葡萄糖的燃烧热依次为285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。
(1)0.1mol甲烷和0.2mol氢气组成的混合气体在25℃、101kPa下完全燃烧释放的热量为 ;
(2)写出表示葡萄糖燃烧热的热化学方程式: ;
(3)有人利用甲烷和氧气的反应设计成如图所示燃料电池,若使用酸性电解质溶液,则两极的电极反应式为:
a极: ,b极: ;
若使用碱性电解质溶液,则b极的电极反应式为:b极: ;
放电时电极a作 极,外电路中电流从 流向 ,电解质溶液中阳离子移向 极;
参考答案:(14分)(1) (2分/个) 146.19kJ/mol
(2) C6H12O6(s) + 6O2(g) 6CO2(g) + 6H2O(l) △H= -2800kJ/mol
6CO2(g) + 6H2O(l) △H= -2800kJ/mol
(3)a极:2O2+ 8H++ 8e-=== 4H2O ;b极:CH4+ 2H2O -8e-===CO2+ 8H+
b极:CH4+ 10OH--8e-===CO32-+7H2O
(1分/个) 正 a b a
本题解析:略
本题难度:简单
4、填空题 I.(1)CH3OH(1)、H2的燃烧热分别为:725.5 kJ/mol和285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH(1)的热化学方程式:?。
(2)右图为光电解水的装置,写出光照时半导体电极表面发生的电极反应式________。目前应用最多的半导体材料是Si,甚至有人提出硅是“21世纪的能源”,硅可作为新能源的原因可能的是?(填字母)。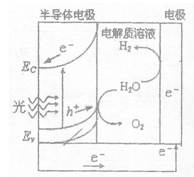
a.在自然界中存在大量的单质硅?
b.硅可以通过化学方法“再生”
c.硅具有较强的亲氧性,燃烧放出的热量多
d.硅的化学性质不活泼,便于安全贮存、运输
II.将0.2mol/L HA溶液与O.lmol/L NaOH溶液等体积混合,测得混合溶液c(Na+)>c(A—),
用“>”、“<”或“=”填写下列空白:
(1)混合溶液中c(A—)____c(HA);c(HA)+c(A—)__0.lmol/L;
(2)混合溶液中,由水电离出来的c(OH—)?0.2mol/L HA溶液中由水电离出的c(H+)
(3)25℃时,如果取0.2mol/L HB溶液与0.lmol/L NaOH溶液等体积混合,测得混合溶液的pH <7,则HB的电离程度?NaB的水解程度。
参考答案: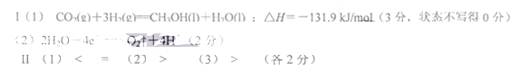
本题解析:略
本题难度:一般
5、选择题 在中和热测定的实验时,应使用的仪器正确组合是。
①天平②量筒③烧杯④酒精灯⑤温度计⑥试管⑦量热计⑧环形玻璃搅拌棒
A.①②④⑤⑧
B.②③⑤⑦⑧
C.②③④⑦⑧
D.全部
参考答案:B
本题解析:根据中和热的测定原理可知,在该实验中需要的仪器是选项B。反应不需要称量和加热,所以天平、酒精灯不需要。反应是在烧杯中进行的,不需要试管。答案选B。
本题难度:一般